Tính khối lượng Nitơ và hiđro có trong 0,1 mol NH3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(\overline{M}_A=5,875.2=11,75\left(g/mol\right)\)
b) Gọi số mol N2, H2 là a, b (mol)
\(\overline{M}_A=\dfrac{28a+2b}{a+b}=11,75\left(g/mol\right)\)
=> 16,25a = 9,75b
=> a = 0,6b
\(\left\{{}\begin{matrix}\%n_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{0,6b}{0,6b+b}.100\%=37,5\%\\\%n_{H_2}=\dfrac{b}{a+b}.100\%=\dfrac{b}{0,6b+b}.100\%=62,5\%\end{matrix}\right.\)
c)
1 mol hỗn hợp A chứa \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{1.37,5}{100}=0,375\left(mol\right)\\n_{H_2}=\dfrac{1.62,5}{100}=0,625\left(mol\right)\end{matrix}\right.\)
\(\overline{M}_B=\dfrac{0,375.28+0,625.2+17x}{1+x}=6,4.2=12,8\left(g/mol\right)\)
=> x = 0,25 (mol)

\(n_{N_2}=\dfrac{2.8}{14}=0.2\left(mol\right)\)
\(n_{KK}=\dfrac{29}{29}=1\left(mol\right)\)
\(n_{NH_3}=\dfrac{34}{17}=2\left(mol\right)\)
\(\%n_{N_2}=\dfrac{0.2}{0.2+1+2}\cdot100\%=6.25\%\)
\(\%m_{N_2}=\dfrac{2.8}{2.8+29+34}\cdot100\%=4.25\%\)

Đáp án : A
nAg = 4nHCHO + 2nHCOOH = 0,1.4 + 0,1.2 = 0,6 mol
=> mAg = 64,8g
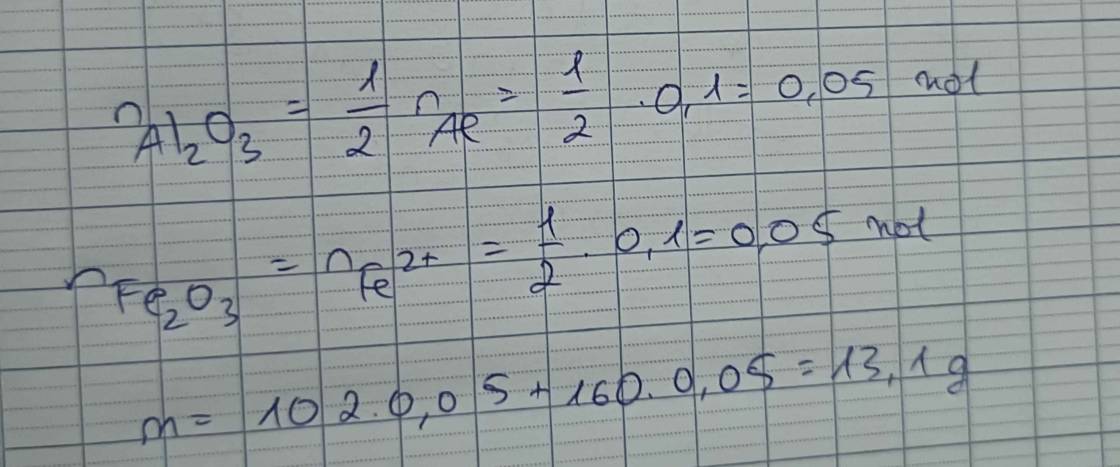
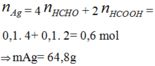

-Số mol mỗi nguyên tố có trong hợp chất:
nN = 1.0,1= 0,1 mol
nH = 3.0,1= 0,3 mol
- Khối lượng mỗi nguyên tố có trong hợp chất :
mN = 0,1 . 14= 1,4 g
mH= 0,3 . 1 = 0,3 g
Số mol mỗi nguyên tố có trong hợp chất là :
nN = 1 x 0,1= 0,1 (mol)
nH = 3 x 0,1= 0,3 (mol)
Khối lượng mỗi nguyên tố có trong hợp chất là :
\(m_N=n_N\times M_N=0,1\times14=1,4\left(g\right)\)
\(m_H=n_H\times M_H=0,3\times1=1\left(g\right)\)
Chúc bạn học tốt =))