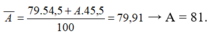Khối lượng nguên tử trung bình của Br là 79,91. Br có hai đồng vị, trong đó đồng vị ( A=79 Br Z=35) chiếm 54,5%. hối lượng nguyên tử của đồng vị thứ 2 ?
GIÚP TỚ VỚI TKS MN NHÌU!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,\(\overset{x}{Br}\)
Ta có:\(79,91=\frac{79\cdot54,5+45,5\cdot x}{100}\)
\(\Rightarrow x=81\)
Vậy đồng vị thứ 2 là 81Br
b Xét 1 mol HBrO3 có \(\left\{{}\begin{matrix}1molH\\1molBr\\3molO\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_H=1g\\m_{Br}=80g\\m_O=48g\end{matrix}\right.\)
\(n_{Br\left(81\right)}=\frac{45.5}{100}\cdot n_{Br\left(80\right)}=0,455\)
\(\%m_{Br\left(81\right)}=\frac{m_{Br\left(81\right)}}{m_{hc}}\cdot100=\frac{0,455\cdot81}{1+80+48}\cdot100=28,6\%\)

Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)

Đáp án A
Khối lượng nguyên tử trung bình của Br là
MBr = ( 79 . 54 , 5 + 81 ( 100 - 54 , 5 ) ) / 100 = 79 , 91

\(\overline{NTK}_{Br}=79,55\\ \Leftrightarrow\dfrac{79.55\%+A_2.45\%}{100\%}=79,55\\ \Leftrightarrow A_2\approx80,22\left(đ.v.C\right)\)

Chọn C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình: