Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)
Brom có hai đồng vị , trong đó đồng vị 79Br chiếm 54,5% . Xác định đồng vị còn lại , biết M Br=79,91

\(\overline{A}=\dfrac{79.54,5\%+A_2.\left(100\%-54,5\%\right)}{100\%}=79,91\Rightarrow A_2=81\)
Đồng vị còn lại là : 81Br

Ta có: \(\overline{M_{Br}}=\dfrac{79\cdot x+81\cdot y}{100}=79,91\)
Mà \(x+y=100\)
\(\Rightarrow\left\{{}\begin{matrix}\%^{79}Br=x=54,5\%\\\%^{81}Br=y=45,5\%\end{matrix}\right.\)

a), Đặt đồng vị thứ 2 của đồng là A2.
\(\overline{NTK}_{Cu}=63,54\\ \Leftrightarrow\dfrac{63.73\%+A_2.27\%}{100\%}=63,54\\ \Leftrightarrow A_2=65\left(đ.v.C\right)\)
b, Khi có 81 nguyên tử đồng vị thứ 2 thì số nguyên tử 63Cu là:
\(\dfrac{81.73}{27}=219\left(nguyên.tử\right)\)
c) Phần trăm khối lượng đồng vị 63Cu có trong phân tử Cu2O là:
\(73\%.\dfrac{63,54.2}{63,54.2+16}\approx64,837\%\)
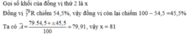

a,\(\overset{x}{Br}\)
Ta có:\(79,91=\frac{79\cdot54,5+45,5\cdot x}{100}\)
\(\Rightarrow x=81\)
Vậy đồng vị thứ 2 là 81Br
b Xét 1 mol HBrO3 có \(\left\{{}\begin{matrix}1molH\\1molBr\\3molO\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_H=1g\\m_{Br}=80g\\m_O=48g\end{matrix}\right.\)
\(n_{Br\left(81\right)}=\frac{45.5}{100}\cdot n_{Br\left(80\right)}=0,455\)
\(\%m_{Br\left(81\right)}=\frac{m_{Br\left(81\right)}}{m_{hc}}\cdot100=\frac{0,455\cdot81}{1+80+48}\cdot100=28,6\%\)