Để dung dịch hòa 1 dung dịch chứa 189g HNO3, đầu tiên người ta dùng dung dịch 112g KaOH . Sau đó người ta lại đổ thêm dung dịch Ba(OH)2 25% cho dung hòa hết axit
a) Viết PT
b) Tính klg dung dịch BAPH đã dùng
MINH ĐANG CẦN GẤP
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nno3=\(\dfrac{m}{M}=\dfrac{189}{63}=3\left(mol\right)\)
nkoh=\(\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
pthh: HNO3 + KOH \(\rightarrow\) HNO3 + H2O 1.
2HNO3 + Ba(OH)2 \(\rightarrow\) Ba(NO3)2 + 2H2O 2.
Theo pthh 1 : nno3 =nkoh=2(mol)
\(n_{hno3dư_{ }}=1\left(mol\right)\)
Theo pthh 2 : nba(oh)2=nhno3=1(mol)
\(\Rightarrow m_{ba\left(ọh\right)_{2_{ }}=n.M=1.171=171\left(g\right)}\)
\(\Rightarrow m_{ddBa\left(oh\right)_2}=\dfrac{m_{ct}.100\%}{C\%}=\dfrac{117.100\%}{25}=468\left(g\right)\)

Theo bài ra ta có :
\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{109,5}{36,5}=3\left(mol\right)\)
\(n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\)
PTHH :
\(HCl+KOH->KCl+H_2O\)
\(2...................2\)
\(Ba\left(OH\right)_2+2HCl-->BaCl_2+H_2O\)
\(0,5.................\left(3-2\right)mol\)
\(m_{Ba\left(OH\right)_2}=0,5.171=85,5\left(g\right)\)
\(m_{ddBa\left(OH\right)_2}=\dfrac{85,5.100\%}{25\%}=342\left(g\right)\)
Vậy ....................
Theo đề bài ta có : \(nHCl=\dfrac{109,5}{36,5}=3\left(mol\right)\)
nKOH = \(\dfrac{112}{56}=2\left(mol\right)\)
PTHH 1 :
\(KOH+HCl\rightarrow KCl+H2O\)
2mol...... 2mol
Theo PTHH 1 ta có tỉ lệ : \(nKOH=\dfrac{2}{1}mol< nHCl=\dfrac{3}{1}mol\)
=> Số mol của HCl dư ( tính theo số mol của KOH)
PTHH 2 :
\(2HCl+Ba\left(OH\right)2\rightarrow BaCl2\downarrow+2H2O\)
(3-2)mol.....1/2(3-2)mol
=> mddBa(OH)2(cần dùng) = \(\dfrac{\left(\dfrac{1}{2}\left(3-2\right)\right).171.100\%}{25\%}=342\left(g\right)\)
Vậy........

nH2SO4 = 2
nNaOH = 1.5
2NaOH + H2SO4 = Na2SO4 + 2H2O
1.5--------0.75
2KOH + H2SO4 = K2SO4 + 2H2O
2.5-------1.25
mKOH = 140 => m dd KOH = 350g

a) nHNO3=189/63=3(mol); nKOH= 112/56=2(mol)
PTHH: KOH + HNO3 -> KNO3 + H2O
Ta có: 3/1 > 2/1
-> KOH hết, HNO3 (dư)
nHNO3(p.ứ)= nKOH=2(mol) -> nHNO3(dư)=3-2=1(mol)
2 HNO3 + Ba(OH)2 -> Ba(NO3)2 + 2 H2O
1________0,5(mol)
b) => mBa(OH)2= 171.0,5= 85,5(g)

nHNO3= 3(mol) nKOH=2 (mol)
HNO3 + KOH -> KNO3+H2O
Trc pu 3 2
(.) pư 2 2
sau pư 1 0
HNO3+ Ba(OH)2 -> Ba(NO3)2+H2O
THEO PT 1 1
THEO ĐB 1 1
==> mdd Ba(OH)2= \(\dfrac{171.100\%}{25\%}=684\left(g\right)\)
Ba(OH)2+ CuCL2-> BaCL2+ Cu(OH)2
1 1
==> mket tua = mCu(OH)2= 1.98=98 (g)
mk cx ko chắc là đúng thông cảm nha

a)
Gọi thể tích hai bazo là V
Suy ra :
n NaOH = 0,1V ; n Ba(OH)2 = 0,15V
n HCl = 0,2.0,2 = 0,04(mol) ; n H2SO4 = 0,2.0,1 = 0,02(mol)
Bản chất của phản ứng là H trong axit tác dụng với OH trong bazo tạo thành nước :
$H + OH \to H_2O$
n H = n HCl + 2n H2SO4 = 0,08(mol)
n OH = n NaOH + 2n Ba(OH)2 = 0,4V
Theo PTHH :
n H = n OH <=> 0,08 = 0,4V <=> V = 0,2(lít)
b) Dung dịch sau pư có :
Na+ : 0,02
Ba2+ :
Cl- : 0,04
Bảo toàn điện tích => n Ba2+ = 0,01(mol)
=> n BaSO4 = n Ba(OH)2 - n Ba2+ = 0,03 - 0,01 = 0,02
m BaSO4 = 0,02.233 = 4,66 gam
vì sao lại có đoạn này vậy ạ :
n H = n HCl + 2n H2SO4 = 0,08(mol)

Đặt nồng độ HCl trong dung dịch A là x
Đặt nồng độ Ba(OH)2 trong dung dịch B là y
- Khi trộn 50ml dung dịch A với 50ml dung dịch B thì HCl dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (1)
0,1y← 0,05y mol
HCl + NaOH → NaCl + H2O (2)
0,005←0,005 mol
Ta có: 2.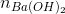 + nNaOH = nHCl
+ nNaOH = nHCl
0,1y + 0,005 = 0,05x
x– 2y = 0,1 (*)
- Khi trộn 50 ml dung dịch A với 150ml thì Ba(OH)2 dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (3)
0,05x→0,025x mol
2HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O (4)
0,035→ 0,0175 mol
Ta có: 2.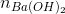 = (nHCl +
= (nHCl + 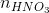 )
)
0,15y = 0,025x + 0,0175
x– 6y = - 0,7 (**)
Giải hệ pt:
x– 6y = -0,7
x– 2y = 0,1
=>x = 0,5; y= 0,2
=>CM của HCl = 0,5M
CM của Ba(OH)2 = 0,2M
PTHH: \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
\(Ba\left(OH\right)_2+2HNO_3\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\\n_{HNO_3}=\dfrac{189}{63}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) HNO3 dư 1 mol
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,5\left(mol\right)\) \(\Rightarrow m_{ddBa\left(OH\right)_2}=\dfrac{0,5\cdot171}{25\%}=342\left(g\right)\)