Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(KOH+HNO_3\rightarrow KNO_3+H_2O\)
\(Ba\left(OH\right)_2+2HNO_3\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\\n_{HNO_3}=\dfrac{189}{63}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) HNO3 dư 1 mol
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,5\left(mol\right)\) \(\Rightarrow m_{ddBa\left(OH\right)_2}=\dfrac{0,5\cdot171}{25\%}=342\left(g\right)\)

nH2SO4 = 2
nNaOH = 1.5
2NaOH + H2SO4 = Na2SO4 + 2H2O
1.5--------0.75
2KOH + H2SO4 = K2SO4 + 2H2O
2.5-------1.25
mKOH = 140 => m dd KOH = 350g

Theo bài ra ta có :
\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{109,5}{36,5}=3\left(mol\right)\)
\(n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\)
PTHH :
\(HCl+KOH->KCl+H_2O\)
\(2...................2\)
\(Ba\left(OH\right)_2+2HCl-->BaCl_2+H_2O\)
\(0,5.................\left(3-2\right)mol\)
\(m_{Ba\left(OH\right)_2}=0,5.171=85,5\left(g\right)\)
\(m_{ddBa\left(OH\right)_2}=\dfrac{85,5.100\%}{25\%}=342\left(g\right)\)
Vậy ....................
Theo đề bài ta có : \(nHCl=\dfrac{109,5}{36,5}=3\left(mol\right)\)
nKOH = \(\dfrac{112}{56}=2\left(mol\right)\)
PTHH 1 :
\(KOH+HCl\rightarrow KCl+H2O\)
2mol...... 2mol
Theo PTHH 1 ta có tỉ lệ : \(nKOH=\dfrac{2}{1}mol< nHCl=\dfrac{3}{1}mol\)
=> Số mol của HCl dư ( tính theo số mol của KOH)
PTHH 2 :
\(2HCl+Ba\left(OH\right)2\rightarrow BaCl2\downarrow+2H2O\)
(3-2)mol.....1/2(3-2)mol
=> mddBa(OH)2(cần dùng) = \(\dfrac{\left(\dfrac{1}{2}\left(3-2\right)\right).171.100\%}{25\%}=342\left(g\right)\)
Vậy........

nno3=\(\dfrac{m}{M}=\dfrac{189}{63}=3\left(mol\right)\)
nkoh=\(\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
pthh: HNO3 + KOH \(\rightarrow\) HNO3 + H2O 1.
2HNO3 + Ba(OH)2 \(\rightarrow\) Ba(NO3)2 + 2H2O 2.
Theo pthh 1 : nno3 =nkoh=2(mol)
\(n_{hno3dư_{ }}=1\left(mol\right)\)
Theo pthh 2 : nba(oh)2=nhno3=1(mol)
\(\Rightarrow m_{ba\left(ọh\right)_{2_{ }}=n.M=1.171=171\left(g\right)}\)
\(\Rightarrow m_{ddBa\left(oh\right)_2}=\dfrac{m_{ct}.100\%}{C\%}=\dfrac{117.100\%}{25}=468\left(g\right)\)

a) nHNO3=189/63=3(mol); nKOH= 112/56=2(mol)
PTHH: KOH + HNO3 -> KNO3 + H2O
Ta có: 3/1 > 2/1
-> KOH hết, HNO3 (dư)
nHNO3(p.ứ)= nKOH=2(mol) -> nHNO3(dư)=3-2=1(mol)
2 HNO3 + Ba(OH)2 -> Ba(NO3)2 + 2 H2O
1________0,5(mol)
b) => mBa(OH)2= 171.0,5= 85,5(g)

PTHH: \(HCl+KOH\rightarrow KCl+H_2O\)
\(2HCl_{\left(dư\right)}+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
Axit dư nên tính theo KOH
Ta có: \(\left\{{}\begin{matrix}\Sigma n_{HCl}=\dfrac{109,5}{36,5}=3\left(mol\right)\\n_{KOH}=\dfrac{112}{56}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{HCl\left(dư\right)}=1\left(mol\right)\)
\(\Rightarrow n_{Ba\left(OH\right)_2}=0,5\left(mol\right)\) \(\Rightarrow m_{ddBa\left(OH\right)_2}=\dfrac{0,5\cdot171}{25\%}=342\left(g\right)\)

Đặt nồng độ HCl trong dung dịch A là x
Đặt nồng độ Ba(OH)2 trong dung dịch B là y
- Khi trộn 50ml dung dịch A với 50ml dung dịch B thì HCl dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (1)
0,1y← 0,05y mol
HCl + NaOH → NaCl + H2O (2)
0,005←0,005 mol
Ta có: 2.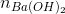 + nNaOH = nHCl
+ nNaOH = nHCl
0,1y + 0,005 = 0,05x
x– 2y = 0,1 (*)
- Khi trộn 50 ml dung dịch A với 150ml thì Ba(OH)2 dư, ta có:
2HCl + Ba(OH)2 → BaCl2 + 2H2O (3)
0,05x→0,025x mol
2HNO3 + Ba(OH)2 → Ba(NO3)2 + H2O (4)
0,035→ 0,0175 mol
Ta có: 2.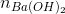 = (nHCl +
= (nHCl + 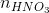 )
)
0,15y = 0,025x + 0,0175
x– 6y = - 0,7 (**)
Giải hệ pt:
x– 6y = -0,7
x– 2y = 0,1
=>x = 0,5; y= 0,2
=>CM của HCl = 0,5M
CM của Ba(OH)2 = 0,2M