Một cốc đựng dung dịch muối cacbonat của một kim loại hóa trị II .Rót từ từ dung dịch H2SO4 có nồng độ 20% vào cốc cho đến khi khí thoát ra vừa hết thì thu được dung dịch muối có nồng độ 24,91%.Hãy xác định muối cacbonat của kim loại gì ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Đặt công thức muối cacbonat kim loại là M2CO3
M2CO3+ H2SO4 → M2SO4 + CO2+ H2O
Giả sử n M 2 C O 3 = 1 mol
→ n H 2 S O 4 = n M 2 S O 4 = n C O 2 = 1mol
→ m H 2 S O 4 = 98 gam; m M 2 S O 4 = 2M+96 gam;
m C O 2 = 44 gam; m d d H 2 S O 4 10 % =980 g
Ta có: mdd sau pứ = m M 2 C O 3 + m d d H 2 S O 4 - m C O 2
=2M + 60+980-44= 2M+996 (gam)
C % M 2 S O 4 = 2 M + 96 2 M + 996 . 100 % = 13 , 63 % → M = 23 → M l à N a

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
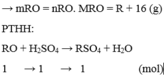
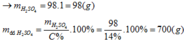
![]()
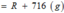
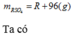

Vậy công thức của oxit kim loại là MgO


Khối lượng dung dịch sau phản ứng:
m d d = 200 + 44 x ( g a m )
Ta có phương trình về tổng nồng độ các chất:
84. ( 2 x − 0,2 ) + 106. ( 0,2 − x ) 200 + 44 x .100 = 0,0663 ⇔ x = 0,15
Phân tử khối của muỗi đem nhiệt phân là: M = 15 0,15 = 100 ( g / m o l ) .
Vậy muối là C a C O 3
⇒ Chọn A.

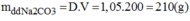
Nồng độ phần trăm của dung dịch pha chế:
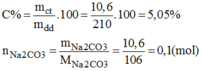
Nồng độ mol của dung dịch:

Tham khảo
Gọi m_ddH2SO4 = 294 gam → nH2SO4 =0,6 mol
R2O3 + 3H2SO4 → R2(SO4)3 +3H2O
0,2 0,6 0,2 0,6
=> m = 294 + 9,6 + 0,4R
=> 0,2(2R + 96.3)/303,6 + 0,4R = 0,21756
=> R = 27 => R = AI
b ơi cái này người ta cho kim loại chứ k phải oxit của kim loại, mà kim loại hóa trị 2 chứ không phải 3 nha :<

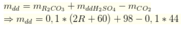


gọi dd muối CO3 là ACO3
ACO3 +H2SO4 -->ASO4 +CO2+H2O
giả sử có 1 mol ACO3
=>mACO3= MA +60(g)
theo PTHH : nH2SO4=nACO3=1(mol)
=>mdd H2SO4=1.98.100/20=490(g)
nASO4=nACO3=1(mol)
=>mASO4=MA +96(g)
nCO2=nACO3=1(mol)
=>mCO2=44(g)
=>\(\dfrac{MA+96}{MA+60+490-44}\).100=24,91
giải ra ta được MA=40(g/mol0
=>ACO3:CaCO3
ta có pthh: ACO3 +H2SO4--ASO4+H2O+CO2
(A+60)g......98g.......(A+96)g..........44g
mdd H2SO4=(98.100):20=490g
mdd muối sau phản ứng=(A+60)+490-44= (A+506)g
theo đê bài ta có:C% ASO4=(A+96).100:A+506
suy ra A=40 CÓ: CTHH :CACO3