Một lượng khí được giam kín trong một xilanh nhờ một pittong.Ở nhiệt độ 27 độ C thể tích khí là 2 lít.Hỏi khi đun nóng xilanh đến 100 độ C thì pittông được nâng lên một đoạn bao nhiêu?Cho biết tiết diện của pitong là S=150cm2 ,không có ma sát giữa pittông và xilanh và pitong vẫn ở trong xilanh(Đáp án:0,0325m)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}p_1=2atm\\V_1=15\\T_1=300^oK\end{matrix}\right.\\ \left\{{}\begin{matrix}p_2=4atm\\V_2=10l\\T_2=?^oK\end{matrix}\right.\\ \dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Leftrightarrow\dfrac{2.15}{300}=\dfrac{4.10}{T_2}\\ \Rightarrow T_2=400^oK\Rightarrow t_2=127^o\)

Đáp án B.
Ta có: Trạng thái đầu: V 1 = 15 lít; p 1 = 2 atm; T 1 = 27 + 273 = 300 K.
Trạng thái sau: V 2 = 12 lít; p 2 = 3,5 atm; T 2 = ?
Áp dụng phương trình trang thái ta được:
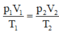
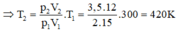
Suy ra t 2 = 420 – 273 = 147 ° C

- Khí trong xi lanh bên trái
+ Trạng thái 1: Trước khi đun nóng: p 0 ; V 0 ; T 0 .
+ Trạng thái 2: Sau khi đun nóng: p 1 ; V 1 ; T 1 .
Vì khối lượng khí không đổi nên:
p 0 V 0 / T 0 = pV/T (1)
- Khí trong xi lanh bên phải
+ Trạng thái 1( trước khi làm nguội): p 0 ; V 0 ; T 0
+ Trạng thái 2(sau khi làm nguội): p 2 ; V 1 ; T 2
Khối lượng khí không đổi nên:
p 0 V 0 / T 0 = p 2 V 1 / T 2 (2)
Vì pit-tông cân bằng nên:
Ở trạng thái 1: 2 p a = 2 p 0
Ở trạng thái 2: 2 p 0 = p 1 + p 2 (3)
Sự thay đổi thể tích tương đối của khí trong xi lanh:
x = ( V 0 - V 1 )/ V 0 (4)
Từ (1), (2), (3), (4) suy ra :
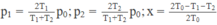

Chon B. Vì khi nung nóng mà bình không đậy kín, một lượng khí sẽ thoát ra ngoài, phương trình trạng thái sẽ không được nghiệm đúng.

Đối với phần khí bị nung nóng:
+ Trạng thái đầu: p 1 ; V 1 = lS; T 1 (1)
+ Trạng thái cuối: p 2 ; V 2 = (l + ∆ l)S; T 2 (2)
Đối với phần khí không bị nung nóng:
+ Trạng thái đầu: p 1 ; V 1 = lS; T 1 (1)
+ Trạng thái cuối: p ' 2 ; V ' 2 = (l - ∆ l)S; T ' 2 = T 1 (2)
Ta có:
p 1 V 1 / T 1 = p 2 V 2 / T 2 = p ' 2 V ' 2 / T 1
Vì pit-tông ở trạng thái cân bằng nên p ' 2 = p 2 . Do đó
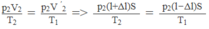
⇒ T 2 = (l + ∆ l/l - ∆ l). T 1
Vậy phải đun nóng khí ở một bên lên thêm ∆ T độ:
![]()
Vì p 1 V 1 / T 1 = p 2 V 2 / T 2 nên:
![]()
Thay số vào ta được:
p 2 ≈ 2,14(atm)

\(p_1=3atm;V_1=18l;T_1=300K\)
\(p_2=4,5atm;V_2=12l\)
a)Quá trình khí lí tưởng:
\(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_2\cdot V_2}{T_2}\Rightarrow\dfrac{3\cdot18}{300}=\dfrac{4,5\cdot12}{T_2}\)
\(\Rightarrow T_2=300K=27^oC\)
b)\(p_3=1atm;T_3=500K\)
Quá trình khí lí tưởng:
\(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_3\cdot V_3}{T_3}\)
\(\Rightarrow\dfrac{3\cdot18}{300}=\dfrac{1\cdot V_3}{500}\)
\(\Rightarrow V_3=90l\)
(1) \(t_1=27^0C\rightarrow T_1=300K.\)
V1 = 2l
(2) \(t_1=100^0C\rightarrow T_2=373K.\)
V2 = ?
Do ma sát giữa pittông và xi lanh không đáng kể nên coi áp suất không đổi. Áp dụng định luật Gay luy xac
=>\(\frac{2}{300}=\frac{V_2}{373}\Rightarrow V_3=2,49l\)
=> thể tích của pittong tăng lên là \(\Delta V=0,49l=490cm^3.\)
=> Pit tông được nâng lên một đoạn là \(h=\frac{\Delta V}{S}=\frac{490}{150}=3,26cm=0,326m.\)
cho hỏi các thầy ở trên học 24 nghĩ như thế nào về đáp án này ạ