Cho 2,1g kim loại A có hóa trị I vào nước dư thu được lượng khí H2 nhỏ hơn 1,12 lít (dktc). Nếu cho 8,2g kim loại A vào nước dư thu được lượng khí H2 thoát ra vượt quá 2,24 lít (Đktc). Xác định kim loại A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tham khảo:
2A+ 2H2O -> 2AOH+ H2
- TN1:
nH2= 0,05 mol
nA= 2,1/A mol
=> 1,05/A < 0,05
=> A > 21 (1)
- TN2:
nH2= 0,1 mol
nA= 8,2/A mol
=> 4,1/A > 0,1
=> A < 41 (2)
(1)(2) => 21 < A < 41
Vậy A= 23 (Na) hoặc A= 39 (K)

2A + H20 ---> H2 + A20
Trường hợp 1 : nH2 < 0,05 ⇒⇒ nA < 0,1 => MA > 2,1 / 0,1 = 21
Trường hợp 2 : nH2 > 0,1 => nA > 0,2 => MA < 41
=> A là Rb ( 37 , hóa trị l )

\(2A+2HCl\rightarrow2ACl+H_2\)
TH1:
\(n_A=\frac{2,1}{A}\left(mol\right)\)
\(\Rightarrow n_{H_2}=\frac{2,1}{2A}< \frac{1,12}{22,4}=0,05\)
\(\Leftrightarrow A>21\left(1\right)\)
TH2:
\(n_A=\frac{8,2}{A}\left(mol\right)\)
\(\Rightarrow n_{H_2}=\frac{8,2}{2A}>\frac{2,24}{22,4}=0,1\)
\(\Leftrightarrow A< 41\left(2\right)\)
Từ (1) và (2) ta suy ra A là Na hoặc K

2A + H2O \(\rightarrow\) H2 + A2O
Trường hợp 1 : nH2 < 0,05 \(\Rightarrow\) nA < 0,1 \(\Rightarrow\) MA > 2,1/0,1 = 21
Trường hợp 2 : nH2 > 0,1 \(\Rightarrow\) nA > 0,2 \(\Rightarrow\) MA < 41
\(\Rightarrow\) A là Rb ( 37 , hóa trị 1 )

\(n_{A\left(1\right)}=\frac{2,1}{A}\left(mol\right);n_{A\left(2\right)}=\frac{8,2}{A}\left(mol\right)\)
PTHH 1: 2A + 2H2O --> 2AOH + H2
\(\frac{2,1}{A}\) -------------------------> \(\frac{1,05}{A}\) (mol)
PTHH 2: 2A + 2H2O --> 2AOH + H2
\(\frac{8,2}{A}\) --------------------------> \(\frac{4,1}{A}\) (mol)
=> \(\frac{1,05}{A}< \frac{1,12}{22,4}\) ; \(\frac{4,1}{A}>\frac{2,24}{22,4}\)
=> \(\frac{1,05}{A}< 0,05\); \(\frac{4,1}{A}>0,1\)
=> 21<A<41 => A là Na,K
MIK NGHĨ ZẬY
\(2A+2H_2O\rightarrow2Aoh+H_2\)
- TN1:
\(n_{H2}=0,05\left(mol\right)\)
\(n_A=\frac{2,1}{A}\left(mol\right)\)
\(\Rightarrow\frac{1,05}{A}< 0,05\Rightarrow A>21\left(1\right)\)
- TN2:
\(n_{H2}=0,1\left(mol\right)\)
\(n_A=\frac{8,2}{A}\left(mol\right)\)
\(\Rightarrow\frac{4,1}{A}>0,1\Rightarrow A< 41\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow21< A< 41\)
Vậy A= 23 (Na) hoặc A= 39 (K)

2) Gọi kim loại hóa trị II là x
X + 2H2O → X(OH)2 + H2
nH2 = 2,24:22,4 =0,1 mol
nX = \(\dfrac{4}{^MX}\)=nH2
=> \(\dfrac{4}{^MX}\)=0,1 => MX=40 => X là kim loại Canxi (Ca)
Bài 1:
a, Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{45}{18}=2,5\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{2,5}{3}\), ta được H2O dư.
Theo PT: \(n_{H_2O\left(pư\right)}=3n_{P_2O_5}=0,3\left(mol\right)\)
\(\Rightarrow n_{H_2O\left(dư\right)}=2,5-0,3=2,2\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=2,2.18=39,6\left(g\right)\)
b, Theo PT: \(n_{H_3PO_4}=2n_{P_2O_5}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_3PO_4}=0,2.98=19,6\left(g\right)\)
Bạn tham khảo nhé!

nH2=2,24/22,4=0,1(mol)
PTHH: X + 2 HCl -> XCl2 + H2
Ta có: nX=nXCl2=nH2=0,1(mol)
=> M(X)=mX/nX=5,6/0,1=56(g/mol)
=>XCl2 là FeCl2
=> m(muối)=mFeCl2=127.0,1=12,7(g)

Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
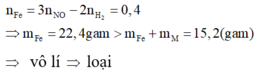
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:


Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
2A +H2O ----> H2 +A2O
trường hợp 1: nH2< 0,05 => nA< 0,1 => MA > 2,1/0,1=21
trường hợp 2:nH2>0,1 => nA> 0,2 => MA < 41
=> A là Rb(37,hóa trị I )
theo mik thì là như vậy :
2A +H2O ----> H2 +A2O
trường hợp 1: nH2< 0,05 => nA< 0,1 => MA > 2,1/0,1=21
trường hợp 2:nH2>0,1 => nA> 0,2 => MA < 41
=> A là Rb(37,hóa trị I )
Chúc bn học tốt