Cho 18.5g hỗn hợp X gồm Fe và Fe3O4 tác dụng với 200ml dd HNO3 loãng đun nóng và khuấy đều. Sau khi phản ứng hoàn toàn thu được 2.24l khí NO duy nhât (đktc), dd Y còn lại 1.46g kim loại .Khối lượng muối trong Y và nồng độ mol của đ HNO3 là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp ban đầu thành Fe và O
Vì sau phản ứng còn dư kim loại => Fe chỉ bị oxi hóa lên Fe2+
Fe --> Fe2+ +2e
x...................2x
O + 2e -> O2-
y........2y
N+5 + 3e -> N+2
0,3.......0,1
Gọi x là nFe, y là nO
Ta có: 56x + 16y = 18,5 - 1,46
2x = 2y + 0,3
Giải ra: x= 0,27 mol, y = 0,12 mol
=> Khối lượng muối trong Y = 0,27 . 180 = 48,6 g
=> nHNO3 = nNO3- (trong muối) + nNO = 0,27.2 + 0,1 = 0,64 mol
=> C(HNO3) = 0,64/0,2 = 3,2 M
\(n_{NO}=\dfrac{2,24}{22,4}=0,1mol\)
3Fe3O4+28HNO3\(\rightarrow\)9Fe(NO3)3+NO+14H2O
x..........\(\rightarrow\dfrac{28x}{3}\)......\(\rightarrow\)3x........\(\rightarrow\)\(\dfrac{x}{3}\)mol
Fe+4HNO3\(\rightarrow\)Fe(NO3)3+NO+2H2O
y...\(\rightarrow\)4y........\(\rightarrow\)y.........\(\rightarrow\)y
Fe+2Fe(NO3)3\(\rightarrow\)3Fe(NO3)2
\(\dfrac{3x+y}{2}\)\(\leftarrow\)3x+y\(\rightarrow\)\(\dfrac{9x+3y}{2}\)
-Sau phản ứng còn lại 1,46 g Fe\(\rightarrow\)mX(pu)=18,5-1,46=17,04g
-Ta có hệ phương trình:
\(\left\{{}\begin{matrix}232x+56\left(y+\dfrac{3x+y}{2}\right)=17,04\\\dfrac{x}{3}+y=0,1\end{matrix}\right.\)
\(\Leftrightarrow\)\(\left\{{}\begin{matrix}316x+84y=17,04\\x+3y=0,3\end{matrix}\right.\)\(\Leftrightarrow\)\(\left\{{}\begin{matrix}x=0,03\\y=0,09\end{matrix}\right.\)
-Muối trong Y chỉ có Fe(NO3)2:\(\dfrac{9x+3y}{2}=\dfrac{9.0,03+3.0,09}{2}=0,27mol\)
\(m_{Fe\left(NO_3\right)_2}=0,27.180=46,8gam\)
\(n_{HNO_3}=\dfrac{28x}{3}+4y=\dfrac{28.0,03}{3}+4.0,09=0,64mol\)
\(C_{M_{HNO_3}}=\dfrac{n}{v}=\dfrac{0,64}{0,2}=3,2M\)

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
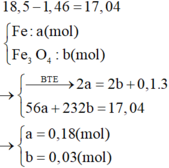
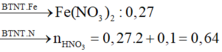
=> [HNO3] = 3,2 (M)

Chọn C.
Ta có: nNO = 0,15 mol.
Gọi a là số mol Cu trong X đã phản ứng; b là số mol Fe3O4 trong X, ta có:
64a + 232b = 61,2 - 2,4
Các nguyên tố Cu, Fe, O trong hỗn hợp X khi phản ứng với HNO3 chuyển thành muối Cu2+, Fe2+ (vì dư kim loại), H2O do đó theo định luật bảo toàn electron, ta có:
2a + 2.3b - 2.4b = 3.0,15 → a = 0,375; b = 0,15
Muối khan gồm: Cu(NO3)2 (a = 0,375 mol) và Fe(NO3)2 (3b = 0,45 mol)
→ mmuối = 188.0,375 + 180.0,45 = 151,5 gam

nNO = 0,15 (mol)
Gọi a là số mol Cu trong X đã phản ứng. Gọi b là số mol Fe3O4 trong X
Ta có: 64a + 232b = 61,2 – 2,4
Các nguyên tố Cu, Fe, O trong hỗn hợp X khi phản ứng với HNO3 chuyển thành muối Cu2+, Fe2+ (vì dư kim loại), H2O do đó theo bảo toàn e: 2a + 2.3b – 2.4b = 3.0,15
Từ đó: a = 0,375; b = 0,15
Muối khan gồm có: Cu(NO3)2 (a = 0,375 mol) và Fe(NO3)2 (3b = 0,45 mol)
mmuối = 188.0,375 + 180.0,45 = 151,5 (gam)
Đáp án B

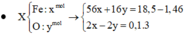
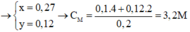

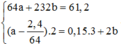
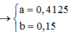
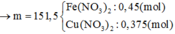
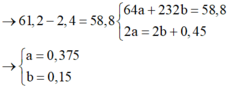
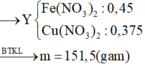
Quy đổi hỗn hợp ban đầu thành Fe và O
Vì sau phản ứng còn dư kim loại => Fe chỉ bị oxi hóa lên Fe2+
Fe --> Fe2+ +2e
x...................2x
O + 2e -> O2-
y........2y
N+5 + 3e -> N+2
0,3.......0,1
Gọi x là nFe, y là nO
Ta có: 56x + 16y = 18,5 - 1,46
2x = 2y + 0,3
Giải ra: x= 0,27 mol, y = 0,12 mol
=> Khối lượng muối trong Y = 0,27 . 180 = 48,6 g
=> nHNO3 = nNO3- (trong muối) + nNO = 0,27.2 + 0,1 = 0,64 mol
=> C(HNO3) = 0,64/0,2 = 3,2 M