Đốt cháy 13,6g hỗn hợp Mg,Fe trong bình khí Clo dư.sau phản ứng thấy thể tích khí Clo Giảm 8,96 lít .tính khối lựng muối clo khan
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cl_2\ pư} = \dfrac{8,96}{22,4} = 0,4(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{hỗn\ hợp} + m_{Cl_2} = 13,6 + 0,4.71 = 42(gam)\)

mtăng = mCl2 = 4.26 (g)
nCl2 = 4.26 / 71 = 0.06 (mol)
VCl2 = 0.06 * 22.4 = 1.344 (l)
=> A
Đốt cháy 11,2 g kim loại Fe trong khí Clo thủ được FeCl3 Tính thể tích khí Clo cần dùng cho phản ứng

PTHH: \(2Fe+3Cl_2\xrightarrow[]{t^o}2FeCl_3\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PTHH: \(n_{Cl_2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=n_{Cl_2}.22,4=0,3.22,4=6,72\left(l\right)\)

Câu 1:
PTHH: \(Na+\dfrac{1}{2}Cl_2\xrightarrow[]{t^o}NaCl\)
Ta có: \(n_{NaCl}=2n_{Cl_2}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\)
Câu 2:
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\) \(\Rightarrow m_{H_2}=0,04\cdot2=0,08\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\) \(\Rightarrow m_{HCl}=0,08\cdot36,5=2,92\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=4,29\left(g\right)\)

P/ứng hóa học: \(Mg+Cl_2->MgCl_2\)
Công thức của p/ứng có phải CT về khối lượng không nhỉ? Mình chưa hiểu lắm. Nếu là CT về kh lượng thì:
\(m_{Mg}+m_{Cl_2}=m_{MgCl_2}\)
* Khối lượng khí clo đã p/ứ:
Theo ĐLBTKL:
\(m_{Mg}+m_{Cl_2}=m_{MgCl_2}\\ =>12g+m_{Cl_2}=47,5g\\ =>m_{Cl_2}=47,5g-12g=35,5g\)
Vậy có 35,5g khí Clo tham gia p/ứng.

Đáp án B
nFe = 0,3 (mol)
2Fe + 3Cl2→ 2FeCl3
0,3 0,45 (mol)
V = 0,45.22,4 = 10,08 (l)
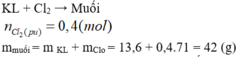
Thể tích khí Clo giảm là do đi vào muối.
Vì vậy: m = 13,6 + 71.0,4 = 42g
mclo khan=13,6+ 71.0,4=42 g
Vậy khối lượng muối clo khan là 42(g)