Lập công thức hóa học của tinh thể MgCl2 biết rằng nếu làm mất H20 kết tinh thì khối lượng muối khan còn lại chỉ chiếm 63,63% khối lượng của tinh thể
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có :
\(\%H_2O = \dfrac{18n}{M + 62.3 + 18n}.100\% = 40,099\%\\ \Rightarrow M + 62.3 = \dfrac{242}{9}n(1)\\ %N = \dfrac{14.3}{M + 62.3 + 18n}.100\% = 10,4\%\\ \Rightarrow M + 18n = \dfrac{2832}{13}(2)\\ (1)(2)\Rightarrow M = 56(Sắt) ; n = 9\)
CTHH cần tìm : \(Fe(NO_3)_3.9H_2O\)
\(\%H_2O= \dfrac{18n}{M + 62.3+18n}.100\% = 40,099\%\\ \Rightarrow M + 62.3 = \dfrac{242}{9}n(1)\\ \%N = \dfrac{14.3}{M + 62.3 + 18n}.100\% = 10,4\%\\ \Rightarrow M + 18n = \dfrac{2832}{13}(2)\\ (1)(2) \Rightarrow M = 56(Sắt) ; n = 9\\ \)
CTHH cần tìm : \(Fe(NO_3)_3.9H_2O\)

gọi công thức của muối là A(NO3)3. nH2O , %N = 10,396
<=> ( 14*3*100)/( A + 186 + 18n) = 10,396 => A + 186 + 18n = 404 (1)
mặt khác % H2O = 40,099 => ( 18*n) /( A+ 186 +18n) = 40,009 (2)
từ 1 và 2 => n=9 , A=56 => công thức cần tìm là Fe(NO3)3.9H2O

Đặt CTPT của muối cacbonat ngậm nước là:

Vậy CTPT của muối cacbonat ngậm nước là Na 2 CO 3 . H 2 O
Đáp án: A

Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
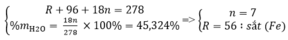
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O

bài này nếu 9h tốiko ai làm thì mk sẽ làm cho nha
chuẩn bị ăn cơm
thôi,làm liều!!!
Gọi CTHH của tinht thể là \(R\left(NO_3\right)_3.nH_2O_{ }\)
ta có %mH2O=40,099%
=> \(\dfrac{18n}{18n+M_R+186}=0,40099\)
Mặt khác %mN= 10,396%
=> \(\dfrac{14.3}{18n+M_R+186}=\dfrac{2599}{25000}\)
=> \(18n+M_R+186\approx404\)
=> \(18n=404.0,40099\approx162=>n=9\)
\(18.9+M_R+186=404=>M_R=56\left(Fe\right)\)
vậy CTHH là \(Fe\left(NO_3\right)_3.9H_2O\)

1/ CTHH dạng TQ là ASO4 . xH2O
%S tinh thể =\(\frac{1.M_S}{M_{ASO4.xH2O}}.100\%=11,5\%\)
=> \(\frac{32}{M_{ASO4.xH2O}}=0,115\)
=> MASO4.xH2O = 278(g)
% H2O kết tinh = \(\frac{x.M_{H2O}}{M_{ASO4.xH2O}}.100\%=45,34\%\)
=> \(\frac{x.18}{287}=0,4534\)
=>x= 7
MASO4.xH2O = 278
mà x = 7
=> MA + 96 + 7 .18=278
=> MA =56(g) => A là Sắt (Fe)
Vậy CTPT của tinh thể là FeSO4 .7H2O
Chúc bạn học tốt

CTHH: R(NO3)2.xH2O (A)
\(\%m_{NO_3^-}=100\%-42,1875\%-9,375\%=48,4375\%\)
Xét \(\dfrac{m_R}{m_{NO_3^-}}=\dfrac{1.M_R}{2.62}=\dfrac{9,375\%}{48,4375\%}\)
=> MR = 24 (g/mol)
=> R là Mg
(A) có CTHH là Mg(NO3)2.xH2O
Có: \(\%m_{H_2O}=\dfrac{18x}{148+18x}.100\%=42,1875\%\)
=> x = 6
=> CTHH: Mg(NO3)2.6H2O
Gọi CT cần tìm là MgCl2.xH2O
Theo bải ra ta có: 95 = 0,6363.(95 + 18x)
Giải ra tìm được: x = 3
Vậy: MgCl2.3H2O