Cho 13,6 g hỗn hợp A gồm Fe và Mg tác dụng với 200ml dd CuSO4 1M đến phản ứng hoàn toàn thu được 18,4 g chất rắn B. Xác định % khối lượng các chất trong A và B.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Đáp án D.
![]()
Giả sử AgNO3 phản ứng hết khi đó Ag+ chuyển hết thành Ag
nAg = = 0,4 mol à mAg = 0,4.108 = 43,2 gam > mA (=32,4 gam)
-> AgNO3 chưa phản ứng hết.
mA = mAg = 32,4 gam à nAg = 0,3 mol
Gọi số mol của Mg và Cu lần lượt là x và y mol
Theo bài ta có: 24x + 64y = 5,6 (1)
Ta có:
Mg à Mg+2 + 2e Ag + e à Ag+
x 2x 0,3 0,3
Cu à Cu+2 + 2e
y 2y
Bảo toàn e ta có: 2x + 2y = 0,3 (2)
Từ (1) và (2) ta có hệ phương trình:
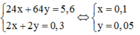
Khối lượng mỗi kim loại trong hỗn hợp đầu là:
mMg = 0,1.24 = 2,4 gam; mCu = 0,05.64 = 3,2 gam.

\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(n_{BaSO_4}=\dfrac{11,65}{233}=0,05\left(mol\right)\)
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
x------>x--------->x------------>x
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
y------>1,5y-------->0,5y-------->1,5y
Có hệ \(\left\{{}\begin{matrix}24x+27y=0,78\\x+1,5y=\dfrac{2,56}{64}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
Giả sử \(CuSO_4\) phản ứng hết, dung dịch C có: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,01\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,5y=0,5.0,02=0,01\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+BaCl_2\rightarrow MgCl_2+BaSO_4\) (1)
0,01-------------------------------->0,01
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4+2AlCl_3\) (2)
0,01------------------------>0,03
Từ PTHH (1), (2) có: \(\Sigma n_{BaSO_4}=0,01+0,03=0,04\left(mol\right)< 0,05\left(mol\right)_{theo.đề}\)
=> Giả sử sai, \(CuSO_4\) dư
\(CuSO_4+BaCl_2\rightarrow BaSO_4+CuCl_2\)
0,01<-----------------0,01
\(CM_{CuSO_4}=a=\dfrac{x+1,5y+0,01}{0,2}=\dfrac{0,01+1,5.0,02+0,01}{0,2}=0,25\left(M\right)\)
Trong A:
\(n_{Al}=0,02\left(mol\right)\\ n_{Mg}=0,01\left(mol\right)\)

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lý => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol; y = 0,06 mol
=> rắn gồm 0,07 mol MgO và 0,03 mol F e 2 O 3 => m = 7,6 (g)

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư => C u 2 + hết
Giả sử chỉ có Mg phản ứng

Bảo toàn khối lượng gốc kim loại:
![]()
![]()
=> rắn gồm 0,07 mol MgO và 0,03 mol
![]()