cho 5,6g Fe tác dụng với \(O_2\)dư sinh ra hỗn hợp gồm Fe dư FeO,\(Fe_2O_3\),\(Fe_3O_4\).Cho toàn bộ lượng chất rắn phản ứng với HCl dư.Sau phản ứng cho dung dịch vào NaOH dư thu được nung kết tủa đến KL không đổi.Tìm KL sinh ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lý => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol; y = 0,06 mol
=> rắn gồm 0,07 mol MgO và 0,03 mol F e 2 O 3 => m = 7,6 (g)

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư => C u 2 + hết
Giả sử chỉ có Mg phản ứng

Bảo toàn khối lượng gốc kim loại:
![]()
![]()
=> rắn gồm 0,07 mol MgO và 0,03 mol
![]()

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư ⇒ C u 2 + hết
Giả sử chỉ có Mg phản ứng ![]()
=> tăng giảm khối lượng ![]()
=> vô lí => Fe phản ứng
Bảo toàn khối lượng gốc kim loại:
24x + 56y = 9,2 + 0,13.64 - 12,48 => x = 0,07 mol => m = 7,6(g)
=> rắn gồm 0,07 mol MgO và 0,03 F e 2 O 3 => m = 7,6 (g)

Chọn đáp án A.
« Trắc nghiệm: Y + HCl dư → 0,04 mol H2; khả năng cao nhất là do 0,04 mol Fe.
12,48 gam Y gồm 0,04 mol Fe + 0,13 mol Cu (từ dung dịch ra) + ? mol Cu ban đầu → ? = 0,03 mol.
Đơn giản lại quá trình:
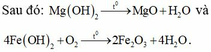
Ta có Z gồm 0,07 mol MgSO4 và 0,06 mol FeSO4 → Khi cho Z + NaOH thu được Mg(OH)2 và Fe(OH)2.
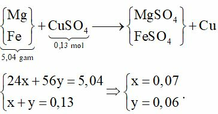
Suy ra m gam chất rắn gồm 0,07 mol MgO và 0,03 mol Fe2O3 → m=7,6 gam.
« Tự luận: cần lập luận chặt chẽ hơn chút. Đó là có thể Mg còn dư trong Y. Nhưng sẽ là dễ thấy ngay TH này không thỏa mãn. Thật vậy, khi đó Z chỉ chứa duy nhất 0,13 mol MgSO4.
→ BTKL phản ứng đầu có m=14,4 mâu thuẫn giả thiết.!

Đáp án A
Do Y tác dụng được với HCl nên Y chứa Fe dư => C u 2 + hết
Giả sử chỉ có Mg phản ứng
![]()
=> tăng giảm khối lượng
![]()
=>vô lí => phản ứng
Bảo toàn khối lượng gốc kim loại:
![]()
![]()
=> rắn gồm 0,07 mol MgO và 0,03 mol
![]()





Chất rắn sau cùng là $Fe_2O_3$
$n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)$
Bảo toàn Fe :
$n_{Fe_2O_3} = \dfrac{1}{2}n_{Fe} = 0,05(mol)$
$m_{Fe_2O_3} = 0,05.160 = 8(gam)$