kể tên các chất hóa học quang trọng được sử dụng nhiều tronh bản tuần hoàn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nguyên tử của nguyên tố ở ô số 6:
- KHHH: C
- Tên nguyên tố: Carbon
- Số hiệu nguyên tử: 6
- Khối lượng nguyên tử: 12
- Số e nguyên tử: 6
---
Nguyên tử của nguyên tố ở ô số 11:
- KHHH: Na
- Tên nguyên tố: Sodium
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: 23
- Số e nguyên tử: 11

loại sản phẩm hoá học được sử dụng nhiều trong sản xuất nông nghiệp hoặc thủ công nghiệp:
+ phân bón hoá học : VD phân NPK , phân Kali, Phan lân , đạm ,..
+thuốc trừ sâu , thuốc diệt cỏ,..
+ chất nhuộm trong công nghiệp dệt vải ...

BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Sơ lược về sự phát minh ra bảng tuần hoàn: Thời Trung cổ, loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân và lưu huỳnh. Năm 1649, loài người tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Năm 1817, Đô-be-rai-nơ (J.Dobereiner) nhận thấy khối lượng nguyên tử của stronti ở giữa khối lượng nguyên tử của hai nguyên tố bari và canxi. Bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau. Tiếp theo, các nhà khoa học đã tìm ra các bộ ba khác có quy luật tương tự.
Năm 1862, nhà địa chất Pháp Đờ Săng - cuốc - toa (De Chancourtoi) đã sắp xếp các nguyên tố hoá học theo chiều tăng của khối lượng nguyên tử lên một băng giấy (băng giấy này được cuốn quanh hình trụ theo hình lò xo xoắn). Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, Giôn Niu-lan (John Newlands), nhà hoá học Anh, đã tìm ra quy luật: Mỗi nguyên tố hoá học đều thể hiện tính chất tương tự như nguyên tố thứ 8 khi xếp các nguyên tố theo khối lượng nguyên tử tăng dần.
Năm 1860, nhà bác học người Nga Men-đê-lê-ép đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hoá học. Năm 1869, ông công bố bản "bảng tuần hoàn các nguyên tố hoá học" đầu tiên. Năm 1870, nhà khoa học người Đức Lô-tha Mây-ơ (Lothar Mayer) nghiên cứu độc lập cũng đã đưa ra một bảng tuần hoàn các nguyên tố hoá học tương tự như bảng của Men-đê-lê-ép.
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Ngày nay, dưới ánh sáng của thuyết cấu tạo nguyên tử, các nguyên tố hoá học được sắp xếp trong bảng tuần hoàn theo các nguyên tắc:
1. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp thành một hàng.
3. Các nguyên tố có cùng số electron hoá trị(1) trong nguyên tử trên được gọi là bảng tuần hoàn các nguyên tố hoá học (gọi tắt là bảng tuần hoàn).
Click ở đây để xem minh họa bảng tuần hoàn
II. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
1. Ô nguyên tố
Mỗi nguyên tố hoá học được xếp vào một ô của hàng, gọi là ô nguyên tố. Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
Thí dụ: (Al) chiếm ô 13 trong bảng tuần hoàn, vậy số hiệu nguyên tử của nguyên tố Al là 13, số đối với điện tích hạt nhân là 13, hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 electron.
2. Chu kì
Chu kì dãy các nguyên tố mà nguyên tử của chúng có cùng số electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Chu kì thường bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1 và chu kì 7).
Bảng tuần hoàn gồm 7 chu kì. Các chu kì được đánh số từ 1 đến 7.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Chu kì 1 gồm 2 nguyên tố là H (Z = 1), 1s1 và He (Z = 2), 1s2.
Nguyên tử của hai nguyên tố này chỉ có 1 lớp electron, đó là lớp K.
Chu kì 2 gồm 8 nguyên tố, bắt đầu là Li (Z = 3), 1s22s1 và kết thúc là Ne (Z = 10), 1s22s22p6.
Nguyên tử của các nguyên tố này có 2 lớp electron: lớp K (gồm 2 electron) và lớp L. Số electron của lớp L tăng dần từ 1 ở liti đến tối đa là 8 ở neon (lớp electron ngoài cùng bão hoà).
Chu kì 3 gồm 8 nguyên tố, bắt đầu từ Na (Z = 11), 1s22s22p63s1 và kết thúc là Ar (Z = 18), 1s22s22p63s23p6. Nguyên tử của các nguyên tố này có 3 lớp electron: lớp K (2 electron), lớp L (8 electron) và lớp M (8 electron). Số electron của lớp M tăng dần từ 1 ở natri đến tối đa là 8 ở agon (lớp electron ngoài cùng bền vững). Bảng dưới đây cho biết số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 2 và 3.
Chu kì 2 | Li | Be | B | C | N | O | F | Ne |
Chu kì 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
Số electron ở lớp ngoài cùng | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Chu kì 4 và chu kì 5: Mỗi chu kì đều có 18 nguyên tố, bắt đầu là một kim loại kiềm (K (Z = 19): [Ar]4s1 và Rb (Z = 37): [Kr]5s1), kết thúc là một khí hiếm (Kr (Z = 36): [Ar]3d104s24p6 và Xe (Z = 54): [Kr]4d105s25p6).
Chu kì 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs (Z = 55), [Xe]6s1 và kết thúc là khí hiếm Rn (Z = 86), [Xe]4f145d106s26p6.
Chu kì 7: Chưa hoàn thành (Chu kỳ dở dang).
Các chu kì 1, 2, 3 được gọi là các chu kì nhỏ.
Các chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6 (được gọi là các nguyên tố thuộc họ lantan) và 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7 (gọi là các nguyên tố họ actini) có cấu hình electron đặc biệt, được xếp thành hai hàng ở phần cuối bảng. Như vậy, nếu trừ 14 nguyên tố trên, chu kì 6 cũng còn 18 nguyên tố như các chu kì 4 và 5, chu kì 7 còn 10 nguyên tố.
3. Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn (xem Bảng tuần hoàn). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hoá trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Ngoài cách chia các nguyên tố người ta còn chia chúng thành các khối như sau:
Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA (được gọi là nhóm kim loại kiềm) và nhóm IIA (được gọi là nhóm kim loại kiềm thổ). Thí dụ:
Na (Z = 11): 1s22s22p63s1; Mg (Z = 12): 1s22s22p63s2;
Các nguyên tố s hoạt động hoá học rất mạnh, còn được gọi là các kim loại hoạt động. Chúng có khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn hầu hết các kim loại khác.
Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ He).
Thí dụ:
O (Z = 8): 1s22s22p4; Ne (Z = 10): 1s22s22p6;
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B.
Khối nguyên tố f gồm các nguyên tố xếp ở hai hàng cuối bảng.
Nhóm B bao gồm các nguyên tố d và nguyên tố f.
Tư liệu
ĐÔI NÉT VỀ ĐI-MI-TRI-VA-NO-VÍCH MEN-ĐÊ-LÊ-ÉP
VÀ ĐỊNH LUẬT TUẦN HOÀN - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Đi-mi-tri I-va-no-vích Men-đê-lê-ép sinh ngày 27 tháng 1 năm 1934 ở thành phố To-bon (Tobonxk), trong một gia đình có 17 người con, bố là hiệu trưởng trường trung học To-bon. Sau khi tốt nghiệp Trường Trung học To-bon, ông vào học tại Trường Đại học Sư phạm Pê-téc-bua và năm 1855, khi tốt nghiệp, ông đã được nhận huy chương vàng. Trong hai năm 1859, 1860 Men-đê-lê-ép làm việc ở Đức. Sau đó, ông trở về nước Nga và được bổ nhiệm là giáo sư của Trường Đại học Kĩ thuật Pe-téc-bua. Hai năm sau, ông được bổ nhiệm là giáo sư của Trường Đại học Tổng hợp Pê-téc-bua. Sau 33 năm nghiên cứu khoa học và giảng dạy, năm 1892 Men-đê-lê-ép được bổ nhiệm làm giám đốc khoa học bảo tồn của Trạm Cân đo mẫu. Năm 1893, trạm này đổi thành Viện Nghiên cứu khoa học đo lường mang tên Men-đê-lê-ép.
Kết quả hoạt động sáng tạo vĩ đại nhất của Men-đê-lê-ép là sự phát minh ra định luật tuần hoàn các nguyên tố năm 1869, lúc đó ông mới 35 tuổi. Ngoài ra, ông còn có nhiều công trình khác có giá trị như: các nghiên cứu về trọng lượng riêng của dung dịch nước, dung dịch của rượu - nước và khái niệm về dung dịch. Những công trình nghiên cứu của Men-đê-lê-ép về dung dịch và phần quan trọng của thuyết dung dịch hiện đại.
Cuốn "Cơ sở hoá học" là công trình xuất sắc của Men-đê-lê-ép, trong đó lần đầu tiên toàn bộ hoá học vô cơ được trình bày theo quan điểm của định luật tuần hoàn. Cuốn sách đã được tái bản rất nhiều lần.
Kết hợp một cách chặt chẽ lí thuyết với thực tế, Men-đê-lê-ép luôn luôn quan tâm đến sự phát triển công nghiệp của đất nước Nga.
Bảng tuần hoàn các nguyên tố có ảnh hưởng lớn đến sự phát triển của hoá học. Nó không những là sự phân loại tự nhiên đầu tiên các nguyên tố hoá học, cho biết các nguyên tố có mối liên hệ chặt chẽ và hệ thống, mà còn định hướng cho việc nghiên cứu tiếp tục các nguyên tố mới.
Ngày nay, định luật tuần hoàn vẫn còn là sợi chỉ dẫn đường và là lí thuyết chủ đạo của hoá học. Trên cơ sở đó, trong những năm gần đây các nguyên tố sau urani đã được điều chế nhân tạo và được xếp sau urani trong bảng tuần hoàn. Một trong các nguyên tố đó là nguyên tố 101 đã được điều chế lần đầu tiên năm 1955 và được đặt tên là mendelevi để tỏ lòng kính trọng nhà bác học Nga vĩ đại.
Việc phát minh ra định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoá học có giá trị to lớn không những đối với hoá học, mà cả đối với triết học.
Thuyết cấu tạo nguyên tử ở thế kỷ XX đã soi sáng vào định luật tuần hoàn và bảng tuần hoàn các nguyên tố, tìm ra nhiều điều mới mẻ sâu sắc hơn. Những lời tiên tri của Men-đê-lê-ép "Định luật tuần hoàn sẽ không bị đe doạ phá vỡ, mà chỉ có sự bổ sung và phát triển" đã có những bằng chứng tuyệt vời.
Bài 8:
SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HOÁ HỌC
I. SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ
Bảng dưới đây cho biết cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A.
Bảng 5. Cấu hình electron lớp ngoài cùng của nguyên tử
các nguyên tố nhóm A
Nhóm Chu kì | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
1 | H 1s1 | He 1s2 | ||||||
2 | Li 2s1 | Be 2s2 | B 2s22p1 | C 2s22p2 | N 2s22p3 | O 2s22p4 | F 2s22p5 | Ne 2s22p6 |
3 | Na 3s1 | Mg 3s2 | Al 3s23p1 | Si 3s23p2 | P 3s23p3 | S 3s23p4 | Cl 3s23p5 | Ar 3s23p6 |
4 | K 4s1 | Ca 4s2 | Ga 4s24p1 | Ge 4s24p2 | As 4s24p3 | Se 4s24p4 | Br 4s24p5 | Kr 4s24p6 |
5 | Rb 5s1 | Sr 5s2 | In 5s25p1 | Sn 5s25p2 | Sb 5s25p3 | Te 5s25p4 | I 5s25p5 | Xe 5s25p6 |
6 | Cs 6s1 | Ba 6s2 | Ti 6s26p1 | Pb 6s26p2 | Bi 6s26p3 | Po 6s26p4 | At 6s26p5 | Rn 6s26p6 |
7 | Fr 7s1 | Ra 7s2 |
|
Xét cấu hình electron nguyên tử của các nguyên tố trong bảng 5 ta thấy: Đầu mỗi chu kỳ là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns1. Kết thúc mỗi chu kỳ là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns2np6 (trừ chu kỳ 1). Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lặp lại sau mỗi chu kỳ, ta nói rằng: chúng biến đổi một cách tuần hoàn.
Như thế, sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
II- CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A
1. Cấu hình electron nguyên tử của các nguyên tố nhóm A
a) Nguyên tử các nguyên tố trong cùng một nhóm A có cùng số electron lớp ngoài cùng. Chính sự giống nhau về cấu hình electron lớp ngoài cùng của nguyên tử là nguyên nhân của sự giống nhau về tính chất hoá học của các nguyên tố trong cùng một nhóm A.
b) Số thứ tự của nhóm (IA, IIA...) có biết số electron lớp ngoài cùng và đồng thời cũng là số electron hoá trị trong nguyên tử các nguyên tố đó.
c) Các electron hoá trị của các nguyên tố thuộc hai nhóm IA, IIA là electron s, các nguyên tố đó là các nguyên tố s. Các electron hoá trị của các nguyên tố thuộc sáu nhóm A tiếp theo là các electron s và p, các nguyên tố đó là các nguyên tố p (trừ He).
2. Một số nhóm A tiêu biểu
a) Nhóm VIIIA là nhóm khí hiếm, gồm các nguyên tố : heli, neon, agon, kripton, xenon và rađon.
Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 lớp electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns2np6). Đó là cấu hình electron bền vững.
Hầu hết các khí hiếm đều không tham gia các phản ứng hoá học (trừ một số trường hợp đặc biệt). Ở điều kiện thường, các khí hiếm đều ở trạng thái và phân tử chỉ gồm một nguyên tử.
b) Nhóm IA là nhóm kim loại kiềm gồm các nguyên tố: liti, natri, kali, rubiđi, xesi (ngoài ra còn có nguyên tố phóng xạ franxi).
Nguyên tử của các nguyên tố kim loại kiềm chỉ có 1 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns1). Vì vậy, trong các phản ứng hoá học, nguyên tử của các nguyên tố kim loại kiềm có khuynh hướng nhường đi 1 electron để đạt đến cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất, các nguyên tố kim loại kiềm chỉ có hoá trị 1.
Các kim loại kiềm là những kim loại điển hình, thường có những phản ứng sau:
- Tác dụng mạnh với oxi tạo thành oxit bazơ tan trong nước, thí dụ Li2O, Na2O,...
- Tác dụng mạnh với nước ở nhiệt độ thường tạo thành hiđro và hiđroxit kiềm mạnh, thí dụ NaOH, KOH,...
- Tác dụng với các phi kim khác tạo thành muối, thí dụ NaCl, K2S,...
c) Nhóm VIIA là nhóm halogen, gồm các nguyên tố: flo, clo, brom, iot (ngoài ra còn có nguyên tố phóng xạ atatin).
Nguyên tử của các nguyên tố halogen có 7 electron ở lớp ngoài cùng (cấu hình electron ở lớp ngoài cùng là ns2np5). Vì vậy, trong các phản ứng hoá học các nguyên tử hlogen có khuynh hướng thu thêm 1 electron để đạt đến cấu hình electron bền vững của khí hiếm (trừ At). Do đó, trong các hợp chất nguyên tố kim loại, các nguyên tố halogen có hoá trị 1.
Ở dạng đơn chất, các phân tử halogen gồm hai nguyên tử: F2, Cl2, Br2, I2. Đó là những phi kim điển hình, thường có những phản ứng sau:
- Tác dụng với kim loại cho các muối như KBr, AlCl3...
- Tác dụng với hiđro tạo ra những hợp chất khí HF; HCl; HBr; HI; trong nước chúng là những dung dịch axit.
- Hiđroxit của các halogen là những axit, thí dụ : HClO, HClO3.
Bài 9:
SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC
NGUYÊN TỐ HOÁ HỌC. ĐỊNH LUẬT TUẦN HOÀN
I - TÍNH KIM LOẠI, TÍNH PHI KIM
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương. Nguyên tử càng dễ mất electron, tính kim loại của nguyên tố càng mạnh.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ thu electron để trở thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh.
Ranh giới tương đối giữa nguyên tố kim loại, phi kim trong bảng tuần hoàn các nguyên tố hoá học (trang 37) được phân cách bằng đường dích dắc in đậm. Phía phải là các nguyên tố phi kim, phía trái là các nguyên tố kim loại.
1. Sự biến đổi tính chất trong một chu kỳ
Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, đồng thời tính phi kim mạnh dần.
Thí dụ: Chu kỳ bắt đầu từ nguyên tố Na (Z = 11), [Ne]3s1, là một kim loại điển hình. Rồi lần lượt đến Mg (Z = 12), [Ne]3s2, là kim loại mạnh nhưng hoạt động kém natri. Al (Z = 13), [Ne]3s23p1, là một kim loại nhưng hiđroxit đã có tính chất lưỡng tính. Si (Z = 14), [Ne]3s23p2 là một phi kim. Từ P (Z = 15), [Ne]3s23p3 đến S (Z = 16), [Ne]3s23p4 tính phi kim mạnh dần. Cl (Z = 17), [Ne]3s23p5 là một phi kim điển hình, rồi đến khí hiếm Ar (Z = 18), [Ne]3s23p6. Quy luật trên được lặp lại đối với mỗi chu kỳ.
Có thể giải thích quy luật biến đổi tính chất trên theo bán kính nguyên tử:
Trong một chu kỳ, khi đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron của nguyên tử các nguyên tố bằng nhau, do đó lực hút của hạt nhân với các electron lớp ngoài cùng tăng lên làm cho bán kính nguyên tử giảm dần (xem hình 2.1), nên khả năng dễ nhường electron (đặc trưng cho tính kim loại của nguyên tố) giảm dần, đồng thời khả năng thu electron (đặc trưng cho tính phi kim của nguyên tố) tăng dần.

Hình 2.1. Bán kính nguyên tử của một số nguyên tố (nm)
Trong mỗi chu kỳ, bán ính nguyên tử giảm từ trái qua phải.
Trong mỗi nhóm A, bán kính nguyên tử tăng theo chiều từ trên xuống dưới
2. Sự biến đổi tính chất trong một nhóm A
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần.
Thí dụ:
Nhóm IA gồm các kim loại điển hình: Tính chất kim loại tăng rõ rệt từ Li (Z = 3), 1s22s1 đến Cs (Z = 55), [Xe]6s1 tức là khả năng mất electron tăng dần. Xesi là nguyên tố kim loại mạnh nhất.
Nhóm VIIA gồm các kim loại điển hình: Tính phi kim giảm dần từ F (Z = 9), 1s22s22p5 đến I (Z = 53), [Kr] 4d105s25p5, tức là khả năng thu thêm electron giảm dần. Flo là nguyên tố phi kim mạnh nhất.
Quy luật đó được lặp lại đối với các nhóm A khác và được giải thích như sau: Trong một nhóm A, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng, nhưng đồng thời số lớp electron cũng tăng làm bán kính nguyên tố tăng nhanh và chiếm ưu thế hơn nên khả năng nhường electron của các nguyên tố càng tăng lên - tính kim loại tăng và khả năng nhận electron của các nguyên tố giảm - tính phi kim giảm.
Nguyên tử Cs có bán kính nguyên tử lớn nhất nên dễ nhường electron hơn cả, nó là kim loại mạnh nhất. Nguyên tử F có bán kính nguyên tử nhỏ nhất nên dễ thu thêm electron hơn cả, nó là phi kim mạnh nhất.
3. Độ âm điện
a) Khái niệm
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Như vậy, độ âm điện của nguyên tử càng lớn thì tính phi kim của nó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính kim loại của nó càng mạnh.
b) Bảng độ âm điện
Trong hoá học, có nhiều thang độ âm điện khác nhau do các tác giả tính toán trên những cơ sở khác nhau. Dưới đây giới thiệu bảng giá trị độ âm điện do nhà hoá học Pau-linh (Pauling) thiết lập năm 1932. Vì nguyên tố flo là phi kim mạnh nhất, Pau-linh quy ước lấy độ âm điện của nó để xác định độ âm điện tương đối của các nguyên tử nguyên tố khác.

Hình 2.2. Nhà hoá học người Mĩ Pau-linh (L.C. Pauling, 1901 - 1994)
Giải thưởng No-ben Hoá học năm 1954, giải thưởng No-ben Hoà bình năm 1962
Bảng 6. Giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A
theo Pau-linh
Nhóm Chu kì | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | H 2,20 | ||||||
2 | Li 0,98 | Be 1,57 | B 2,04 | C 2,55 | N 3,04 | O 3,44 | F 3,98 |
3 | Na 0,93 | Mg 1,31 | Al 1,61 | Si 1,90 | P 2,19 | S 2,58 | Cl 3,16 |
4 | K 0,82 | Ca 1,00 | Ga 1,81 | Ge 2,01 | As 2,18 | Se 2,55 | Br 2,96 |
5 | Rb 0,82 | Sr 0,95 | In 1,78 | Sn 1,96 | Sb 2,05 | Te 2,1 | I 2,66 |
6 | Cs 0,79 | Ba 0,89 | T1 1,62 | Pb 2,33 | Bi 2,02 | Po 2,0 | At 2,2 |
Trong một chu kỳ, khi đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung tăng dần.
Trong một nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung giảm dần.
Quy luật biến đổi độ âm điện phù hợp với sự biến đổi tính kim loại, tính phi kim của các nguyên tố trong một chu kỳ và trong một nhóm A mà ta đã xét ở trên.
Kết luận: Tính kim loại, tính phi kim của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
II - HOÁ TRỊ CỦA CÁC NGUYÊN TỐ
Trong một chu kỳ, đi từ trái sang phải, hoá trị cao nhất của các nguyên tố trong hợp chất với oxi tăng lần lượt từ 1 đến 7, còn hoá trị của các phi kim trong hợp chất với hiđro giảm từ 4 đến 1.
Thí dụ: trong chu kỳ 3, ba nguyên tố đầu chu kỳ (Na, Mg, Al) tạo thành hợp chất oxit, trong đó chúng có hoá trị lần lượt là 1, 2, 3. Các nguyên tố tiếp theo (Si, P, S, Cl) có hoá trị lần lượt là 4, 5, 6,7 trong oxit cao nhất.
Các nguyên tố phi kim Si, P, S, Cl tạo được hợp chất với hiđro, trong đó chúng có hoá trị lần lượt 4, 3, 2,1.
Đối với các chu kỳ khác, sự biến đổi hoá trị của các nguyên tố cũng diễn ra tương tự (xem trang 7).
Bảng 7. Sự biến đổi tuần hoàn hoá trị của các nguyên tố
Số thứ tự nhóm A | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
Hợp chất với oxi | Na2O K2O | MgO CaO | Al2O3 Ga2O3 | SiO2 GeO2 | P2O5 As2O5 | SO3 SeO3 | Cl2O7 Br2O7 |
Hoá trị cao nhất với oxi | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Hợp chất khí với hiđro | SiH4 GeH4 | PH3 AsH3 | H2S H2Se | HCl HBr | |||
Hoá trị với hiđro | 4 | 3 | 2 | 1 |
II - OXIT VÀ HIĐROXIT CỦA CÁC NGUYÊN TỐ NHÓM A
Trong một chu kỳ, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần.
Bảng 8. Sự biến đổi tính axit - bazơ
Na2O Oxit bazơ | MgO Oxit bazơ | Al2O3 Oxit lưỡng tính | SiO2 Oxit axit | P2O5 Oxit axit | SO3 Oxit axit | Cl2O7 Oxit axit |
NaOH Bazơ mạnh (kiềm) | Mg(OH)2 Bazơ yếu | Al(OH)3 Hiđroxit lưỡng tính | H2SiO3 Axit yếu | H3PO4 Axit trung bình | H2SO4 Axit mạnh | HClO4 Axit rất mạnh |
Tính bazơ yếu dần đồng thời tính axit mạnh dần
Sự biến đổi tính chất như thế được lặp lại ở các chu kỳ sau.
IV - ĐỊNH LUẬT TUẦN HOÀN
Trên cơ sở khảo sát sự biến đổi tuần hoàn của cấu hình electron nguyên tử, bán kính nguyên tử, độ âm điện của nguyên tử, tính kim loại và tính phi kim của các nguyên tố hoá học, thành phần và tính chất các hợp chất của chúng, ta thấy tính chất của các nguyên tố hoá học biến đổi theo chiều điện tích hạt nhân tăng, nhưng không liên tục mà tuần hoàn.
Định luật tuần hoàn về các nguyên tố hoá học được phát biểu như sau:
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Bài 10:
Ý NGHĨA CỦA BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC
I - QUAN HỆ GIỮA VỊ TRÍ CỦA NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại (xem sơ đồ sau):
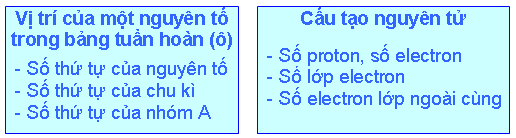
Thí dụ 1: Biết nguyên tố có số thứ tự là 19 thuộc chu kỳ 4, nhóm IA, có thể suy ra:
Nguyên tử của nguyên tố đó có 19 proton, 19 electron.
Nguyên tử đó có 4 lớp electron (vì số lớp electron bằng số thứ tự của chu kì).
Có 1 electron ở lớp ngoài cùng (vì số electron lớp ngoài cùng bằng số thứ tự của nhóm A). Đó là nguyên tố kali.
Thí dụ 2: Biết cấu hình electron nguyên tử của một nguyên tố là 1s22s22p63s23p4 có thể suy ra:
Tổng số electron của nguyên tử đó là 16, vậy nguyên tố đó chiếm ô thứ 16 trong bảng tuần hoàn (vì nguyên tử có 16 electron, 16 proton, số đơn vị điện tích hạt nhân là 16, bằng số thứ tự của nguyên tố trong bảng tuần hoàn).
Nguyên tố đó thuộc chu kì 3 (vì có 3 lớp electron) thuộc nhóm VIA (vì có 6 electron lớp ngoài cùng). Đó là nguyên tố lưu huỳnh.
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra những tính chất hoá học cơ bản của nó:
- Tính kim loại, tính phi kim:
Các nguyên tố ở các nhóm IA, IIA, IIIA (trừ hiđro và bo) có tính kim loại Các nguyên tố ở các nhóm VA, VIA, VIIA (trừ antimon, bitmut và poloni) có tính phi kim.
- Hoá trị cao nhất của nguyên tố trong hợp chất với oxi, hoá trị của nguyên tố trong hợp chất với hiđro.
- Công thức oxit cao nhất.
- Công thức hợp chất khí với hiđro (nếu có).
- Công thức hiđroxit tương ứng (nếu có) và tính axít hay bazơ của chúng.
Thí dụ: Nguyên tố lưu huỳnh ở ô thứ 16, nhóm VIA, chu kì 3. Suy ra: lưu huỳnh là phi kim.
Hoá trị cao nhất với oxi là 6, công thức oxit cao nhất là SO3.
Hoá trị với hiđro là 2, công thức hợp chất khí với hiđro là H2S.
SO3 là oxit axít và H2SO4 là axít mạnh.
III. SO SÁNH TÍNH CHẤT HOÁ HỌC CỦA MỘT NGUYÊN TỐ VỚI CÁC NGUYÊN TỐ LÂN CẬN
Dựa vào quy luật của các nguyên tố trong bảng tuần hoàn có thể so sánh tính chất hoá học của một nguyên tố với các nguyên tố lân cận.
Thí dụ: So sánh tính chất hoá học của P (Z = 15) với Si (Z = 14) và S (Z = 16) với N (Z = 7) và As (Z = 33).
Trong bảng tuần hoàn, các nguyên tố Si, P, S thuộc cùng một chu kì. Nếp xếp theo chiều điện tích hạt nhân tăng dần ta được dãy Si, P, S. Trong chu kì, theo chiều điện tích hạt nhân tăng thì tính phi kim tăng. Vậy, P có tính phi kim yếu hơn S và mạnh hơn Si.
Trong nhóm VA, theo chiều điện tích hạt nhân tăng dần, ta có dãy N, P, As, tính phi kim giảm dần. P có tính phi kim kém hơn N và mạnh hơn As.
Vậy P có tính phi kim yếu hơn N và S, hiđroxit của nó là H3PO4 có tính axít yếu hơn HNO3 và H2SO4.
Bài 11:
LUYỆN TẬP
BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ VÀ TÍNH CHẤT CỦA
CÁC NGUYÊN TỐ HOÁ HỌC
A. KIẾN THỨC CẦN NẮM VỮNG
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sếp xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố có cùng lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có cùng số electron hoá trị như nhau được xếp thành một cột.
b) Ô nguyên tố: Mỗi nguyên tố xếp vào một ô
c) Chu kì
- Mỗi hàng là một chu kì.
- Bảng có 7 chu kì: 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
- Nguyên tử các nguyên tố thuộc một chu kì có số electron như nhau.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
d) Các nhóm A (từ IA đến VIIIA) gồm các nguyên tố ở chu kì nhỏ và chu kì lớn. Các nguyên tố nhóm IA, IIA là nguyên tố s, các nguyên tố từ nhóm IIIA đến VIIIA là nguyên tố p.
Các nhóm B ( từ IIIB đến VIIIB rồi IB và IIB theo chiều từ trái sang phải trong bảng hệ thống tuần hoàn) chỉ gồm các nguyên tố ở chu kì lớn. Các nguyên tố thuộc nhóm B là các nguyên tố d và f.
2. Sự biến đổi tuần hoàn
a) Cấu hình electron của nguyên tử
Số electron lớp ngoài cùng của nguyên tử các nguyên tố ở mỗi chu kì tăng từ 1 đến 8 thuộc các nhóm từ IA đến VIIIA. Cấu hình electron nguyên tử của các nguyên tố biến đổi tuần hoàn.
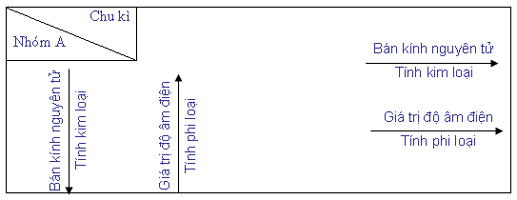
b) Sự biến đổi tuần hoàn tính kim loại, tính phi kim, bán kính nguyên tử và giá trị độ âm điện của các nguyên tử được tóm tắt trong bảng sau:
3. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Chú thích: Chiều mũi tên là chiều tăng
3. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Mk ghi hết các chất hoa học lun, hok tốt! (^O^)

Dùng kính hiển vi để quan sát vật rất nhỏ như hồng cầu

Thức ăn, đồ uống không có lợi nếu thường xuyên sử dụng nhiều đối với các cơ quan tiêu hóa, tuần hoàn, thần kinh là: lạp xưởng, đồ uống có gas, thịt xiên nướng, chân giò muối, gà rán, bánh kẹo ngọt, khoai tây chiên, hamburger.

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X- Hợp chất Y là MX
Theo giả thiết ta có:
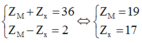
=> M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
=> Cl thuộc chu kì 3; nhóm VIIA

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X-
⇒ Hợp chất Y là MX
Theo giả thiết ta có:

⇒ M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
⇒ K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
⇒ Cl thuộc chu kì 3; nhóm VIIA

câu 6: Các thể cơ bản của chất: chất rắn, chất lỏng, chất khí.
tính chất thể rắn: chất rắn có khối lượng, hình dạng và thể tích xác định
tính chất thể lỏng: chất lỏng có khối lượng xác định, không có hình dạng xác định mà có hình dạng của vật chứ nó. chất lỏng dễ chảy.
tính chất thể khí: chất khí có khối lượng xác định nhưng không có hình dạng và thể tích xác định. chất khí có thể lan tỏa theo mọi hướng và chiếm toàn bộ thể tíchcủa bất kì vật nào chứa nó
câu 6: Các thể cơ bản của chất: chất rắn, chất lỏng, chất khí.
tính chất thể rắn: chất rắn có khối lượng, hình dạng và thể tích xác định
tính chất thể lỏng: chất lỏng có khối lượng xác định, không có hình dạng xác định mà có hình dạng của vật chứ nó. chất lỏng dễ chảy.
tính chất thể khí: chất khí có khối lượng xác định nhưng không có hình dạng và thể tích xác định. chất khí có thể lan tỏa theo mọi hướng và chiếm toàn bộ thể tíchcủa bất kì vật nào chứa nó
câu 7 : chất lỏng, khí

Oxygen, Hydrogen, Nitrogen, Carbon, Sodium (Natri), Chlorine (Clo), Felium (sắt), Sunfua (Lưu huỳnh), Alum (nhôm),....