X là dung dịch NaOH có pH = 12; Y là dung dịch H2SO4 có pH = 2. Để trung hòa 200 ml dung dịch X cần V ml dung dịch Y. Giá trị của V là:
A. 100
B. 200
C. 400
D. 300
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
pH = 11 → [ OH - ] = 10 - 3 (M)
pH = 12 → [ OH - ] = 10 - 2 (M)
Tổng số mol OH - có trong dung dịch X là: n = 0 , 1 . 10 - 3 + 0 , 05 . 10 - 2 = 6 . 10 - 4 (mol)
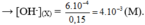

Đáp án A
pH = 12 => pOH = 2 => [OH-] = 10-2 => n NaOH = 0,01 . 0.1 = 0.001 mol
pH = 2 =>[H+] = 10-2 => dung dịch sau khi trộn dư axit : V dd sau trộn = 0,1+ 0,1 = 0,2 lít
=> n H+ dư = 0,2 . 10-2 = 0,002 mol
H+ + OH-→ H2O
x 0,001
0,002 (dư )
=> n H+ban đầu = 0,003 mol => n H2SO4 = 0,0015 mol
=> CM = 0,015
Chú ý:
Chú ý: tính lại nồng độ khi trộn dung dịch làm nồng độ từng chất bị thay đổi

Chọn đáp án D
Chú ý : PH=2 suy ra nồng độ H+ là 0,01.Nhiều bạn sẽ cho môi trường là trung tính ngay.Nhưng các bạn chú ý nhé .HCOOH không điện ly hoàn toàn sau khi H+ đã điện ly phản ứng hết với NaOH nó lại tiếp tục điện ly ra H+ do đó môi trường sẽ là axit

Đáp án A
Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 => pOH = 2 => [OH-] = 10-2M => nOH-trước khi pha loãng = 10-2V
pH = 11 => pOH = 3 => [OH-] = 10-3M => nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng => 10-2V = 10-3V’
![]()
Vậy cần pha loãng dung dịch NaOH 10 lần
Đáp án B