Số lít khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn 0,2 gam khí hiđro là
(Cho NTK: H =1 ; O=16)
A.3,36.
B.2,24.
C.1,12.
D.11,2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
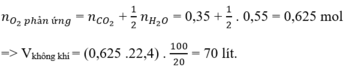

\(2C_2H_2+5O_2-^{t^o}\rightarrow4CO_2+2H_2O\\ n_{C_2H_2}=\dfrac{1,3}{26}=0,05\left(mol\right)\\ n_{O_2}=\dfrac{5}{2}n_{C_2H_2}=0,125\left(mol\right)\\ \Rightarrow V_{O_2}=2,8\left(l\right)\\ Vìtrongkhôngkhíchứa20\%O_2\\ \Rightarrow V_{kk}=\dfrac{2,8}{20\%}=14\left(l\right)\)

$1)$
$4Na+O_2\xrightarrow{t^o}2Na_2O$
$3Fe+2O_2\xrightarrow{t^o}Fe_3O_4$
$2Cu+O_2\xrightarrow{t^o}2CuO$
$2Na+2HCl\to 2NaCl+H_2$
$Fe+2HCl\to FeCl_2+H_2$
$2Na+2H_2O\to 2NaOH+H_2$
$2)$
$n_{O_2}=0,225(mol)$
$n_{H_2(TN_2)}=0,25(mol)$
$n_{H_2(TN_3)}=0,1(mol)$
Theo PT: $\begin{cases} n_{Na}=2n_{H_2(TN_3)}=0,2(mol)\\ 0,5n_{Na}+n_{Fe}=n_{H_2(TN_2)}=0,25(mol)\\ 0,25n_{Na}+\dfrac{2}{3}n_{Fe}+0,5n_{Cu}=n_{O_2}=0,225(mol) \end{cases}$
$\to\begin{cases} n_{Na}=0,2(mol)\\ n_{Fe}=0,15(mol)\\ n_{Cu}=0,15(mol) \end{cases}$
$\to \begin{cases} \%n_{Na}=\dfrac{0,2}{0,2+0,15+0,15}.100\%=40\%\\ \%n_{Fe}=\%n_{Cu}=\dfrac{0,15}{0,2+0,15+0,15}.100\%=30\% \end{cases}$
$\to m=0,2.23+0,15.56+0,15.64=22,6(g)$

TK
a) C2H4 + O2 ---> 2CO2 + 2H2O
0,3 ---->. 0,6
- V CO2 = 0,6×22,4 = 13,44 lít
b) CO2 + Ca(OH)2 ---> CaCO3 + H2O
0,6 ---> 0,6
m Ca(OH)2 = 0,6×74 = 44,4 g
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,2 0,1 ( mol )
\(V_{O_2}=0,1.22,4=2,24l\)
=> Chọn B