Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) CTHH: CxHy
\(M_A=\dfrac{1,34}{\dfrac{1}{22,4}}=30\left(g/mol\right)\)
\(m_C=\dfrac{30.80}{100}=24\left(g\right)\Rightarrow x=\dfrac{24}{12}=2\)
\(m_H=\dfrac{30.20}{100}=6\left(g\right)\Rightarrow y=\dfrac{6}{1}=6\)
=> CTHH: C2H6
b)
Y + O2 --to--> CO2 + H2O + N2
Do đốt cháy Y được sản phẩm chứa các nguyên tố C, H, O, N
=> Y bắt buộc phải chứa C, H, N; có thể có O
c) Hiện tượng: Chất rắn màu đen chuyển dần sang màu đỏ
\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
Gọi số mol CuO pư là a (mol)
PTHH: CuO + H2 --to--> Cu + H2O
a--->a--------->a
=> 80(0,125 - a) + 64a = 8,4
=> a = 0,1 (mol)
=> VH2(đktc) = 0,1.22,4 = 2,24 (l)

a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S

\(n_{metan}=\dfrac{2,24}{22,4}=0,1mol\)
\(V_{kk}=28l\Rightarrow V_{O_2}=\dfrac{28}{5}=5,6l\Rightarrow n_{O_2}=0,25mol\)
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
0,1 0,25 0 0
0,1 0,2 0,1 0,2
0 0,15 0,1 0,2
Sau phản ứng oxi còn dư và \(V_{CO_2}=0,1\cdot22,4=2,24l\)
\(V_{ddCO_2}=2,24+28-0,2\cdot22,4=25,76l\)
\(\%V=\dfrac{2,24}{25,76}\cdot100\%=8,7\%\)

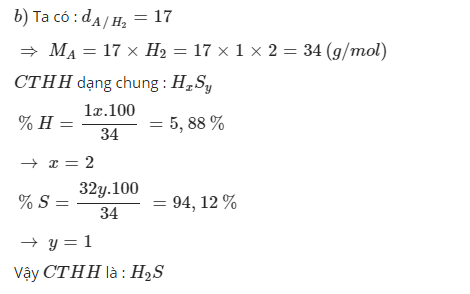
Nguyên tố hoá học buộc phải có trong chất A là Cácbon và Hiđro. Nguyên tố hoá học có thể có hoặc không có trong thành phần chất A là oxi.
Chất A phải có C vì khi cháy tạo ra CO2.
Chất A phải có H vì khi cháy tạo ra H2O.
Chất A có thể không có oxi, khi đó oxi của không khí sẽ kết hợp với C và H tạo ra CO2 và H2O.