Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
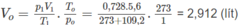
Số mol các chất trong bình trước phản ứng là:
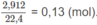
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
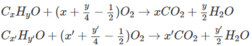
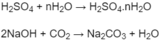
Số mol
H
2
O
là: 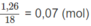
Số mol
C
O
2
là: 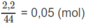
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 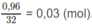
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
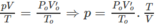
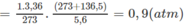
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.

1. 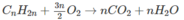
Khi đốt 1 moi C n H 2 n , khối lượng C O 2 nhiều hơn khối lượng nước 26n gam.
Khi đốt 0,03 mol C n H 2 n , khối lượng C O 2 nhiều hơn khối lượng nước 3,12 g.
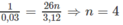
2. Các CTCT
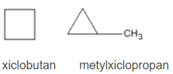
3. Chất A làm mất màu nước brom, vậy A phải có vòng ba cạnh, chất A là metylxiclopropan.

Đáp án: D
Giả sử X là R-CH2OH
R-CH2OH + CuO
→
t
o
R-CHO + Cu + H2O
nCu = 4,8 : 16 = 0,3 mol.
→ nRCHO = nH2O = 0,3.
Mhh khí và hơi = 19 x 2 = 38 → (R + 29 + 18) : 2 = 38 → R = 29 → C2H5-
Vậy X là C2H5-CH2-OH
m = 0,3 x 60 = 18 gam

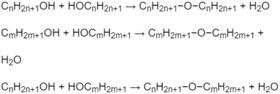
Số mol 3 ete = số mol
H
2
O
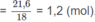
Số mol mỗi ete 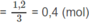
Khối lượng 3 ete :
(28n + 18).0,4 + (28m + 18).0,4 + (14n + 14m + 18).0,4 = 72.0 ⇒ n + m = 3.
Vì n và m đều nguyên và dương nên chỉ có thể n = 1 và m = 2 (hoặc ngược lại).
Hai ancol là C H 3 - O H và C H 3 - C H 2 - O H .
Số mol mỗi ancol là 1,2 mol.
Khối lượng C H 3 - O H là: 1,2.32 = 38,4 (g).
Khối lượng C 2 H 5 O H là: 1,2.46 = 55,2 (g).

Đáp án A
Hướng dẫn
X chứa C3H7OH và có M = 46 => ancol còn lại là CH3OH
Gọi nCH3CH2CH2OH = a mol; nCH3COCH3 = b mol => nCH3OH = a + b mol
=> nO = a + b + a + b = 0,2 (1)
Y gồm CH3CH2CHO (a mol) ; CH3-CO-CH3 (b mol) và HCHO (a + b) mol
=> nAg = 2.nCH3CH2CHO + 4.nHCHO = 2a + 4.(a + b) = 0,45 (2)
Từ (1) và (2) => a = 0,025; b = 0,075
=> %mCH3CH2CH2OH = 16,3%

a)
Gọi CTPT chung của 2 ancol là ROH
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> nROH = 0,5 (mol)
=> \(M_{ROH}=\dfrac{18,8}{0,5}=37,6\left(g/mol\right)\)
=> 1 trong 2 ancol là CH3OH (Do có M < 37,6 g/mol)
=> Ancol còn lại là C2H5OH
CTCT: \(\left\{{}\begin{matrix}CH_3OH:\left(metanol\right)\\CH_3-CH_2OH\left(etanol\right)\end{matrix}\right.\)
b)
Gọi \(\left\{{}\begin{matrix}n_{CH_3OH}=a\left(mol\right)\\n_{C_2H_5OH}=b\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a+b=0,5\\32a+46b=18,8\end{matrix}\right.\)
=> a = 0,3 (mol); b = 0,2 (mol)
\(\left\{{}\begin{matrix}\%m_{CH_3OH}=\dfrac{0,3.32}{18,8}.100\%=51,06\%\\\%m_{C_2H_5OH}=\dfrac{0,2.46}{18,8}.100\%=48,94\%\end{matrix}\right.\)