Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Tốc độ trung bình phản ứng
v ¯ = a - 0 , 01 50 = 4 . 10 - 5 ( mol l S ) => a = 0,012 (mol/l)

Câu 23 bạn tự áp vào công thức là tính ra Ea thôi. Nên em tự làm nhé
Câu 24: \(\overline{v}=\frac{\left|\Delta C\right|}{\Delta t}=\frac{0,05}{1}=0,05M.phút^{-1}\)
Câu 25
vsau = vtrước.3,33(80-25):10= 747.vtrước
=> Thời gian thực hiện pứ = 2/747 giờ

Câu 21, 23: Em thay dữ kiện vào công thức:
\(ln\frac{k_1}{k_2}=\frac{-E_a}{R}.\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\)
Câu 22: không đổi do tốc độ pứ hệ không phụ thuộc vào thể tích hỗn hợp.
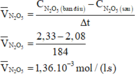

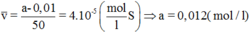
Áp dụng công thức:
Đáp án C.