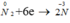Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

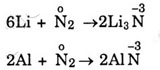
Trong 2 phản ứng với liti và nhôm, nitơ là chất oxi hóa vì có số oxi hóa giảm tử 0 xuống -3.

Phản ứng nhiệt phân:
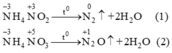
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.Ở cả hai phản ứng nitơ nguyên tử trong ion NH+4 đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2- ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3-) xuống +1.

1. Phương trình hoá học của các phản ứng :
2 N H 3 + 3CuO → t ° N 2 + 3Cu + 3 H 2 O (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
CuO + 2HCl → C u C l 2 + H 2 O (2)
2. Số mol HCl phản ứng với CuO : n H C l = 0,02.1 = 0,02 (mol).
Theo (2), số mol CuO dư : n C u O = n H C l / 2 = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu - số mol CuO dư = 0,03 (mol).
Theo (1) n N H 3 = 2 n C u O /3 = 0,02 (mol) và nN2 = n C u O /3 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01. 22,4 = 0,224 (lít) hay 224 ml.

Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3
Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì