Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

tham khảo:
le_linh06/03/2020
Đáp án:
Tính chất hóa học của oxit
1. Oxit bazơ
- Tác dụng với nước: Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm)
VD: Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Những oxit bazơ tác dụng với nước và do đó cũng tan được trong nước là:
Na2O, K2O, CaO, BaO, Li2O, Rb2O, Cs2O, SrO
- Tác dụng với axit:
Oxit bazơ + axit → muối + nước
VD: Fe2Fe2 O33 + 3H22 SO44 → Fe22 (SO44) 33 +3H22O
- Tác dụng với oxit axit: Một số oxit bazơ, là những oxit bazơ tan trong nước tác dụng với oxit axit tạo thành muối.
2. Oxit axit
-Tác dụng với nước tạo thành dung dịch axit
Oxit axit + nước -> axit
CO2CO2 + H22 O -> H22 CO33
- Tác dụng với dung dịch bazơ tạo thành muối và nước
SO33 + 2NaOH -> Na22SO44 +H22O
- Tác dụng với 1 số oxit bazơ tạo thành muối
CO22 +CaO -> CaCO3

4. Trắc nghiệm vận dụng:
Câu 1: Chất nào sau đây không có tính axit?
A. HCl B. CO2 C. H2SO4 D. NaOH
Câu 2: Dung dịch axit clohidric phản ứng được với chất nào sau đây?
A. Al2O3 B. SO2 C. Na2SO4 D. Cu
Câu 3: Dung dịch axit clohidric không phản ứng được với chất nào sau đây?
A. CuO B. KOH C. Ag D. NaHCO3
Câu 4: Dung dịch axit sunfuric loãng phản ứng được với dãy chất nào sau đây?
A. CuO, NaOH, Na2SO4 B. Fe, Al2O3, BaCl2
C. Ag, Ba(OH)2, CaCO3 D. NaHCO3, NaCl, Fe(OH)2.
Câu 5: Phản ứng giũa cặp chất nào không thu được chất khí?
A. Al và dung dịch HCl. B. NaHCO3 và dung dịch H2SO4.
C. Cu và dung dịch H2SO4 đặc. D. Ba(OH)2 và dung dịch H2SO4
Câu 6: Phản ứng nào sau đây đúng?
A. Fe + HCl → FeCl3 + H2 C. CuO + H2SO4 → CuSO4 + SO2 + H2O
B. Na2SO3 + H2SO4đ → Na2SO4 + SO2 + H2O D. Cu + H2SO4 → CuSO4 + H2
Câu 7: Nhận định nào sau đây là sai?
A. Để phân biệt dung dịch NaOH và dung dịch HCl có thể dùng quỳ tím.
B. Để phân biệt dung dịch H2SO4 loãng và dung dịch HCl có thể dùng BaCl2.
C. Để phân biệt dung dịch H2SO4 lõang và dung dịch H2SO4 đặc có thể dùng Cu.
D. Để phân biệt dung dịch Na2SO4 và dung dịch H2SO4 loãng có thể dùng Ba(OH)2.
Câu 8: Tính chất không phải của dung dịch H2SO4 loãng là
A. làm quỳ tím hóa đỏ. B. tính háo nước.
C. trung hòa các bazơ. D. tạo kết tủa trắng với muối tan của Bari.
Câu 9: Để pha loãng axit H2SO4 đặc, chúng ta cần
A. rót từ từ nước vào axit và khuấy. B. rót từ từ axit vào nước và khuấy.
C. đổ nhanh nước vào axit và khuấy. D. đổ nhanh axit vào nước và khuấy.
Câu 10: Để chuyên chở dung dịch H2SO4 đặc, người ta thường dùng các bồn chứa làm bằng kim loại
A. Al. B. Fe. C. Cu. D. Mg.
Câu 11: Khi bỉ bỏng axit sunfuric đặc, biện pháp sơ cứu nào sau đây là hợp lý?
A. Rửa vết bỏng dưới vòi nước mát, sau đó rửa bằng dung dịch NaHCO3.
B. Rửa vết bỏng dưới vòi nước mát, sau đó rửa bằng dung dịch nước vôi.
C. Rửa vết bỏng dưới vòi nước mát, sau đó bôi kem đánh răng lên vết bỏng.
D. Không rửa vết bỏng bằng bất cứ dung dịch nào, đưa bệnh nhân đến trung tâm y tế.
Câu 12: Trong công nghiệp, axit sunfuric được sản xuất từ
A. SO3. B. CuSO4. C. S hoặc FeS2. D. SO2.
Câu 13: Để chữa bệnh đau dạ dày do thừa axit, người ta thường dùng
A. xút(NaOH). B. natri bicarbonat(NaHCO3). C. muối ăn(NaCl). D. giấm(CH3COOH).
Câu 14: Khi bị kiến cắn, ta thường cảm thấy ngứa do trong dịch kiến cắn có chứa axit. Để giảm triệu chứng
đó ta có thể dùng ….. để bôi vào vết kiến cắn. Từ cần điền vào chỗ trống là
A. vôi. B. nước chanh. C. muối ăn. D. giấm.
Câu 15: Cho các phản thí nghiệm sau:
(1) Cu + dung dịch H2SO4 loãng. (2) Cu + dung dịch H2SO4 đặc.
(3) CuO + dung dịch H2SO4 loãng. (4) Cu(OH)2 + dung dịch H2SO4 đặc.
Số phản ứng có thể tạo thành muối CuSO4 là
A. 1. B. 2. C. 3. D. 4.

Tác dụng với HCl
\(a,\\CuO+2HCl\to CuCl_2+H_2O\\ Mg+2HCl\to MgCl_2+H_2\\ Al_2O_3+6HCl\to 2AlCl_3+3H_2O\\ Fe(OH)_3+3HCl\to FeCl_3+3H_2O\\ Fe_2O_3+6HCl\to 2FeCl_3+3H_2O\)
\(b,\\ Cu+2H_2SO_4\to CuSO_4+2H_2O+SO_2\\ CuO+H_2SO_4\to CuSO_4+H_2O\\ Mg+2H_2SO_4\to MgSO_4+2H_2O+SO_2\\ Al_2O_3+3H_2SO_4\to Al_2(SO_4)_3+3H_2O\\ 2Fe(OH)_3+3H_2SO_4\to Fe_2(SO_4)_3+6H_2O\\ Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ C_6H{12}O_6\to6 C+6H_2O\)

a) CO2 + H2O --> H2CO3
P2O5 + 3H2O --> 2H3PO4
CaO + H2O --> Ca(OH)2
SO2 + H2O --> H2SO3
b) FeO + 2HCl --> FeCl2 + H2O
ZnO + 2HCl --> ZnCl2 + H2O
CaO + 2HCl --> CaCl2 + H2O
c) CO2 + 2NaOH --> Na2CO3 + H2O
P2O5 + 6NaOH --> 2Na3PO4 + 3H2O
SO2 + 2NaOH --> Na2SO3 + H2O

\(a.HCl+NaOH\rightarrow NaCl+H_2O\)
PỨ trung hoà
\(b,n_{NaOH}=0,1.1=0,1mol\\ n_{NaCl}=n_{NaOH}=n_{HCl}0,1mol\\ m=m_{HCl}=0,1.36,5=3,65g\\ c,m_{NaCl}=0,1.58,5=5,85g\\ d,n_{HCl}=\dfrac{73.10}{100.36,5}=0,2mol\\ \Rightarrow\dfrac{0,1}{1}< \dfrac{0,2}{1}\Rightarrow HCl.dư\\ n_{HCl,pứ}=n_{NaOH}=0,1mol\\ m_{HCl,dư}=\left(0,2-0,1\right).36,5=3,65g\)

\(a.Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ b.Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\\ c.2Na+S\xrightarrow[]{t^0}Na_2S\\ d.Ca+Cl_2\xrightarrow[]{t^0}CaCl_2\\ e.MgO+2HNO_3\rightarrow Mg\left(NO_3\right)_2+H_2O\\ f.Fe+2HCl\rightarrow FeCl_2+H_2\\ g.CuO+2HCl\rightarrow CuCl_2+H_2O\\ h.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ i.Cl+2NaOH\rightarrow NaCl+NaClO+H_2O\\ k.MgO_2+4HCl_{đặc}\xrightarrow[nhẹ]{đun}MgCl_2+Cl_2+2H_2O\)

nCuO=0.2(mol)
CuO+2HCl->CuCl2+H2O
0.2 0.4 0.2
m muối=0.2*(64+71)=27(g)
m HCl=14.6(g)
CM=0.4/0.2=2(M)
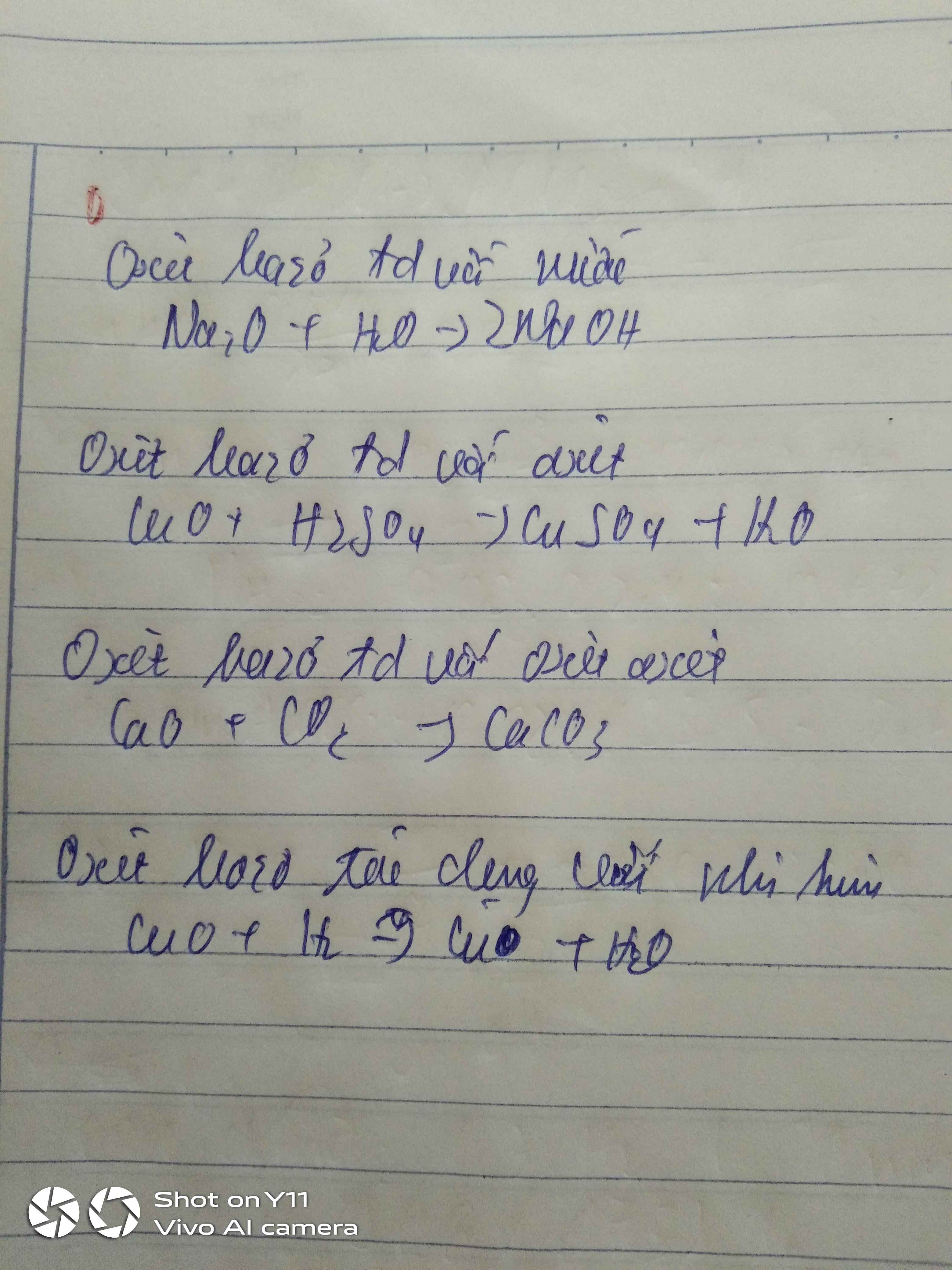
Ba(OH)2 + 2 HCl -> BaCl2 + H2O
NaOH + HCl -> NaCl + H2O
KOH + HCl -> KCl + H2O
MgO +2 HCl -> MgCl2 + H2O
Ca(OH)2 +2 HCl -> CaCl2 + H2O
FeO + 2 HCl -> FeCl2 + H2
CuO +2 HCl -> CuCl2 + H2O
Fe3O4 + 8 HCl -> FeCl2 + 2 FeCl3 + 4 H2O
HCl + NaOH → NaCl + H2O
HCl + KOH → KCl + H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
2HCl + Ba(OH)2 → BaCl2 + 2H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O