Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

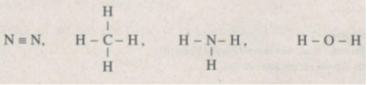
Các liên kết trong phân tử N 2 là các liên kết cộng hoá trị điển hình, không phân cực vì đó là những liên kết giữa hai nguyên tử giống nhau (hiệu độ im điện bằng không).
Các liên kết trong các phân tử còn lại là các liên kết giữa các nguyên tử trong cùng một chu kì (C, N, O) và nguyên tử H (độ âm điện bằng 2,20). ri trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải nên so với H, hiệu độ âm điện cũng tăng theo, do đó các liên kết trong phân tử H 2 O là các liên kết phân cực mạnh nhất.

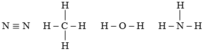
| N2 | CH4 | H2O | NH3 | |
| Hiệu độ âm điện | 0 | 0,35 | 1,24 | 0,84 |
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

- Phân tử H2 được tạo bởi 2 nguyên tử H, đều có độ âm điện là 2,2.
- Như vậy lực hút electron của 2 nguyên tử H bằng nhau. Vậy trong phân tử H2 cặp electron sẽ không bị lệch về nguyên tử nào.

Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: N 2 và H 2 O (1,0 điểm)


- CT electron và CT Lewis của NH3:
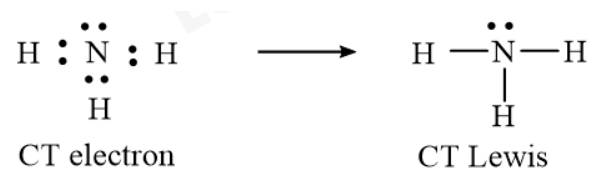
⟹ NH3 còn 1 cặp electron riêng của N.
- Vì N còn 1 của phân tử NH3 còn 1 cặp electron riêng và có độ âm điện lớn hơn nguyên tử H của phân tử H2O.
⟹ Một phân tử H2O có khả năng tạo thành liên kết hydrogen với một phân tử NH3, liên kết tạo bởi H và N.

Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).
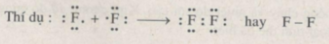

Nguyên tử H của H của của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4. Vì nguyên tử C của phân tử CH4 không còn cặp electron riêng: