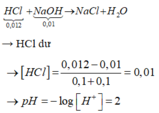Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2SO_4}=1.0,5=0,5(mol)\\ \Rightarrow m_{H_2SO_4}=0,5.98=49(g)\\ m_{H_2SO_4(96\%)}=\dfrac{100.49}{96}\approx 51,04(g)\\ \Rightarrow V_{dd_{H_2SO_4(96\%)}}=\dfrac{51,04}{1,83}\approx 27,89(l)\)
Pha chế:
Đổ khoảng 400 ml nước cất vào cốc chia độ có dung tích 1 lít. Rót từ từ \(27,89ml\) \(H_2SO_4\) \(96\%\) vào cốc, khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500 ml. Ta đã pha chế được 500 ml dung dịch \(H_2SO_4\) 1M.

Ta có: \(m_{ddH_2SO_4\left(96\%\right)}=1000\cdot1,84=1840\left(g\right)\) \(\Rightarrow m_{H_2SO_4\left(96\%\right)}=1840\cdot96\%=1766,4\left(g\right)\)
+) Dung dịch 10%
Gọi số gam nước cần thêm là x
\(\Rightarrow\dfrac{1766,4}{1766,4+1000+x}=0,1\) \(\Leftrightarrow x=14897,6\left(g\right)\)
Vậy đổ thêm 14897,6 ml nước vào 1 lít dd H2SO4 96%
+) Dung dịch 40%
Gọi số gam nước cần thêm là y
\(\Rightarrow\dfrac{1766,4}{1766,4+1000+y}=0,4\) \(\Leftrightarrow y=1649,6\)
Vậy cần đổ thêm 1649,6 ml nước vào dd H2SO4 96%

Đáp án C
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
n FeSO 4 dư = 0,0075.0,015 = 1,125. 10 - 4 mol
25 ml FeSO4 tương đương với 35 ml dung dịch chuẩn K2Cr2O7
=> n K 2 Cr 2 O 7 phản ứng = 35 - 7 , 5 1000 . 0 , 015 = 4 , 125 . 10 - 4 mol
⇒ n Cr ( quặng ) = 2 n K 2 Cr 2 O 7 phải ứng . 100 20 = 4 , 125 . 10 - 3 mol
⇒ % m Cr ( quặng ) = 52 . 4 , 125 . 10 - 3 1 . 100 % = 21 , 45 %


Phản ứng với Ba(OH)2 →kết tủa gồm: 0,3 mol BaCO3 và 0,1 mol BaSO4
→ m = 82,4g
V CO 2 = 2 , 24 lít
Đáp án C

Đáp án C
H+ + OH– → H2O || Trung hòa ⇒ nOH– = nH+ = 0,01 mol.
⇒ x = 0,01 ÷ 0,05 = 0,2M