
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Xét hiệu độ âm điện các nguyên tố trong phân tử, ta có:
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2S\): \(2,58-2,20=0,38< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HF:\) \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion
\(BF_3:\) \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion
\(LiF:\) \(3,98-0,98=3,00>1,7\text{ }\Rightarrow\) Liên kết ion
\(ClO_2\): \(3,44-3,16=0,28< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.

Xét hiệu độ âm điện :
\(P_2O_5\): \(3,44-2,19=1,25>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HAt\): \(2,20-2,2=0< 0,4\text{ }\Rightarrow\)Liên kết cộng hoá trị không cực.
\(C_3O_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CsF\): \(3,98-0,79=3,19>1,7\text{ }\Rightarrow\) Liên kết ion.
\(NaCl\): \(3,16-0,93=2,23>1,7\text{ }\Rightarrow\) Liên kết ion.
\(CaO\): \(3,44-1,00=2,44>1,7\text{ }\Rightarrow\) Liên kết ion.
\(PN\): \(3,04-2,19=0,85>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(ClF_3\): \(3,98-3,16=0,82>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.

Xét hiệu độ âm điện :
\(C_2N_2\): \(3,04-2,55=0,49>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HBr\): \(2,96-2,20=0,76>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HI\): \(2,66-2,20=0,46>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(H_2O_2\): \(3,44-2,20=1,24>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(S_3\): \(2,58-2,58=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(N_2O\): \(3,44-3,04=0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(SO_2\): \(3,44-2,58=0,86>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(C_6H_6\): \(2,55-2,20=0,35< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(LiF\): \(3,98-0,98=3,0\text{ }\Rightarrow\) Liên kết ion.
\(H_2S\): \(2,58-2,20=0,38< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(N_2H_4\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.

Trả lời :
\(HNO\): \(H-N=O\)
\(C_2N_2\): \(N\equiv C-C\equiv N\)
\(HCN\): \(H-C\equiv N\)
\(C_3O_2\): \(O=C=C=C=O\)
\(N_2O\): \(N\equiv N\rightarrow O\)

Xét hiệu độ âm điện của các phân tử :
\(H_2\): \(2,20-2,20=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_2\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_3\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2O\): \(3,44-2,20=1,24>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(BF_3\): \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HF\): \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HCl\): \(3,16-2,20=0,96>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(N_2\): \(3,04-3,04=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NO\): \(3,44-3,04=0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
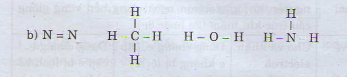
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

(1) \(2H_2Se+O_2\underrightarrow{t^o}2H_2O+2Se\)
(2) \(2Cu\left(NO_3\right)_2\underrightarrow{t^o}2CuO+4NO_2\uparrow+O_2\uparrow\)
(3) \(4Sn+8HCl+2HNO_3\rightarrow5H_2O+N_2O\uparrow+4SnCl_4\)
(4) \(3Cu_2S+6FeS_2+40HNO_3\rightarrow6CuSO_4+3Fe_2\left(SO_4\right)_3+40NO\uparrow+20H_2O\)

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.