Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Coi\ n_{O_2} = 1(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 2(mol) \\ m_{KMnO_4} = 2.158 =316(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}(mol)\\ m_{KClO_3} = \dfrac{2}{3}.122,5 = 81,6(gam)\\ \Rightarrow m_{KMnO_4} > m_{KClO_3}(316<81,6)\)

a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.

\(a.2KClO_3-^{t^o}\rightarrow2KCl+3O_2\\ n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,6\left(mol\right)\\ \Rightarrow V_{O_2}=0,6.22,4=13,44\left(l\right)\\ n_{KCl}=n_{KClO_3}=0,4\left(mol\right)\\ \Rightarrow m_{KCl}=0,4.74,5=29,8\left(g\right)\)

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
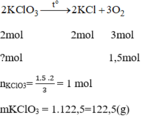
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
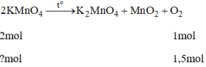
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{a}{158}.............................\dfrac{a}{79}\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{a}{122.5}............\dfrac{3a}{245}\)
\(TC:\)
\(\dfrac{a}{79}>\dfrac{3a}{245}\)
=> Lượng Cl2 điều chế từ KMnO4 lớn nhất.

PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2 ↑
Số mol của K2MnO4 là: 78,8 : 197 = 0,4 mol
Số mol của KMnO4 là: 142,2 : 158 = 0,9 mol
So sánh: \(\frac{0,9}{2}>0,4\)
=> KMnO4 chưa được nhiệt phân hết. Tính theo K2MnO4
a) Số mol của MnO2 là: 0,4 mol
Khối lượng MnO2 thu đc là: 0,4 . 87 = 34,8 (gam)
b) Số mol của O2 là: 0,4 mol
Thể tích O2 thu đc là: 0,4 . 22,4 = 8,96 lít
c) Khối lượng O2 thu đc là: 0,4 . 32 = 12,8 gam
pt: 2 KMnO4 ----to--> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,9 mol 0,4 mol
nKMnO4 = 142,2 / 158 = 0,9 mol
nK2MnO4 = 78,8 / 197 = 0,4 mol
Tỉ lệ : \(\frac{0,9}{2}\) > \(\frac{0,4}{1}\)
Vậy n KMnO4 dư nên kê mol các chất còn lại theo n K2MnO4
pt: 2 KMnO4 -----to----> K2MnO4 + MnO2 + O2
2mol 1mol 1mol 1mol
0,8 mol 0,4mol 0,4mol 0,4mol
a) mMnO2= n.M 0,4 . 87 = 34,8 g
b) VO2= n . 22,4 = 0,4 . 22,4 = 8,96 lít
c) mO2 = n.M = 0,4 . 32 = 12,8 g
Chúc bạn học tốt !!!!
![]()

\(Coi\ n_{O_2} = 3(mol)\\ 2KMnO_4 \xrightarrow K_2MnO_4 + MnO_2+ O_2\\ n_{KMnO_4} = 2n_{O_2} = 6(mol)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 2(mol)\\ \dfrac{m_{KMnO_4}}{m_{KClO_3}} = \dfrac{6.158}{2.122,5} = 3,869\)
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(2a................................a\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{2a}{3}..................a\)
\(m_{KMnO_4}=2a\cdot158=316a\left(g\right)\)
\(m_{KClO_3}=\dfrac{2}{3}a\cdot122.5=\dfrac{245a}{3}\left(g\right)\)
\(\dfrac{m_{KMnO_4}}{m_{KClO_3}}=\dfrac{316a}{\dfrac{245a}{3}}=\dfrac{948}{245}\)

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

\(KClO3\rightarrow KCl+\frac{3}{2}O2\left(1\right)\)
\(2KMnO4\rightarrow K2MnO4+MnO2+O2\left(2\right)\)
a, Giả sử số mol O2 ở phản ứng là 1
Thì số mol các chất ban đầu là
\(n_{KClO3}=\frac{2}{3}\left(mol\right)\)
\(n_{KMnO4}=2\left(mol\right)\)
Khối lượng KMnO4 nhiều hơn
b,Giả sử khối lượng của chất ban đầu là 1.
\(\Rightarrow\left(1\right)n_{O2}=\frac{3}{2}\left(mol\right)\)
\(\left(2\right)n_{O2}=\frac{1}{2}\left(mol\right)\)
\(\rightarrow\) (1) thu được oxi nhiều hơn