Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Cấu hình electron của N (Z = 7): 1s22s22p3
- Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho 2 nguyên tử N.
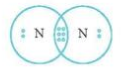
⟹ Số cặp electron dùng chung là 3.
⟹ Công thức Lewis của N2:
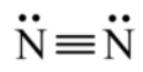

Đáp án D
Cấu hình electron nguyên tử của C (Z = 6) là 1s22s22p2, nguyên tử cacbon có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử của O (Z = 8) là 1s22s22p4, nguyên tử oxi có 6 electron ở lớp ngoài cùng.
Trong phân tử CO2, nguyên tử C nằm giữa hai nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mối nguyên tử O góp chung với nguyên tử C hai electron tạo ra 2 liên kết đôi.
Ta có công thức cấu tạo: O=C=O.
→ Số cặp electron dùng chung trong phân tử CO2 là 4

Chọn C
Cấu hình electron nguyên tử N: N có 5electr 1 s 2 2 s 2 2 p 3 . on lớp ngoài cùng, do đó khi hình thành liên kết trong phân tử N 2 , mỗi nguyên tử N sẽ góp chung 3 electron.

- Nguyên tố H và F sẽ góp chung 1 electron để đạt cấu hình electron bền vững.
⟹ Số electron chung là: 2
- H có hóa trị cao nhất là I ⟹ Electron hóa trị riêng của H là 1.
- F có hóa trị cao nhất là IIV ⟹ Electron hóa trị riêng của F là 7.

CHe: [Ar]4s2
Theo quy tắc bát tử thì nguyên tử sẽ nhường hoặc nhận e để đạt đến cấu hình e có 8 e lớp ngoài cùng
=> Ca có 2e lớp ngoài cùng => Có thể có những TH sau:
1. Nhận 6e
2. Nhường 2e
=> Nhường 2 e là dễ nhất => A

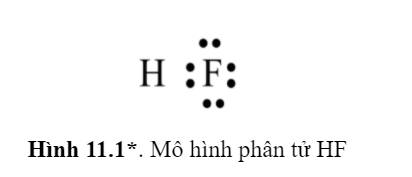
Trong phân tử Clo có bao nhiêu cặp electron dùng chung?
A. 1. B. 2. C. 3. D. 0.
Dễ thấy Clo có công thức cấu tạo: \(Cl-Cl\)
\(\rightarrow1\) cặp e dùng chung
( Nói cách khác dễ hiểu hơn thì Clo thuộc nhóm VIIA nên cần góp chung 1 e để tạo cấu hình bền vững)