Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do bình không dãn nở vì nhiệt, nên công do khí sinh ra : A' = p ∆ V = 0. Theo nguyên lí I, ta có :
∆ U = Q (1)
Nhiệt lượng do khí nhận được : Q = m c V ( T 2 - T 1 ) (2)
Mặt khác, do quá trình là đẳng tích nên :
![]()
Từ (2) tính được : Q = 15,58. 10 3 J.
Từ (1) suy ra: ∆ U = 15,58. 10 3 J.

Đáp án A
Kí hiệu ![]() lần lượt là khối lượng hidro và heli chứa trong hỗn hợp;
μ
1
và
μ
2
là khối lượng mot của chúng:
lần lượt là khối lượng hidro và heli chứa trong hỗn hợp;
μ
1
và
μ
2
là khối lượng mot của chúng:
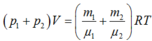
Mà ![]()
![]()
Từ đó rút ra:
![]()

Gọi V là thể tích của bình và pn là áp suất gây nổ.
Đối với khí nitơ ta có: p n V = m N μ N R T N (1)
Đối với khí hiđrô ta có: p n 5 V = m H μ H R T H (2)
Từ (1) và (2) ⇒ m H = m N . T N . μ H 5. T H . μ N = 27 , 55 g

+ Gọi V là thể tích của bình và p n là áp suất gây nổ.
+ Đối với khí nitơ ta có:
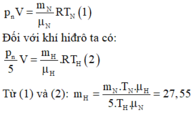

Đáp án: D
Phản ứng xảy ra:
2H2 + O2 → 2H2O.
Theo đó 12g Oxy sẽ kết hợp với 4.12/32 = 1,5g Hidro và thành 13,5 g hơi nước.
Sau phản ứng trong bình có m1 = 3,5g khí hidro và m2 = 13,5g hơi nước.
Lượng nhiệt tỏa ra từ phản ứng là:
Q = Q0.13,5/18 = 1,8.105J.
Lượng nhiệt này sẽ làm tăng nội năng của hơi nước và khí hidro.
Ta có: Q = (c1m1 + c2m2)∆T
![]()
=> Nhiệt độ khí trong bình là
T = T0 + ∆T =2589 K
Vậy áp suất trong bình là:
p = p1 + p2
![]()

Đáp án A
Gọi ![]()
lần lượt là khối lượng ôxi trong bình nước và sau khi dùng:

Mặt khác ![]()
suy ra ![]()
Ghi chú: khi giải bài này ta đã coi khí ôxi ở áp suất 150 atm vẫn là lí tưởng, vì thế kết quả chỉ gần đúng (sai lệch có thể đến cỡ 5%)