Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 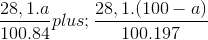 = 0,2
= 0,2
=> a = 29,89.

Áp dụng ĐLBTKL:
mhh = mX + mY + mCO3 = 10 g; mA = mX + mY + mCl = 10 - mCO3 + mCl.
số mol CO3 = số mol CO2 = 0,03 mol.
Số mol Cl = 2 (số mol Cl2 = số mol CO3) (vì muối X2CO3 tạo ra XCl2, Y2CO3 tạo ra 2YCl3).
Do đó: mA = 10 - 60.0,03 + 71.0,03 = 10,33g.

m chất rắn giảm =m oxi mất đi => n [O]=0,32/16=0,02 (mol)
n CO,H2= n [O]=0,02 (mol)
=> V =0,02.22,4=0,448 lít

a) Khối lượng TNT thu được.
b) Khối lượng axit HNO3 đã phản ứng.
Hướng dẫn.
- HS viết pthh ở dạng CTPT.
- Tìm mối liên quan giữa chất đã biết và chất rắn cần tìm.
ĐS: Khối lượng TNT là: = 56,75 (kg).
Khối lượng HNO3 Phản ứng là: = 47,25 (kg).

Gọi CT của A là CxHyO2.
CxHyO2 + (x+y/4 - 1)O2 ---> xCO2 + y/2H2O
Trong 3,7 gam khí A, có số mol = 1,6/32 = 0,05 mol. Do đó phân tử khối của A = 3,7/0,05 = 74. Do đó: 12x + y = 74 - 32 = 42.
Mặt khác số mol của CO2 = 6,6/44 = 0,15 mol; số mol H2O = 2,7/18 = 0,15 mol = số mol CO2. Dựa vào pt phản ứng ta có: y = 2x.
Giải hệ 2 pt trên thu được x = 3; y = 6. CT của A: C3H6O2.
Số mol A = 1/3 số mol CO2 = 0,05 mol. Suy ra m = 74.0,05 = 3,7 g.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

Các cặp chất là đổng đẳng của nhau : C3H7OH và C4H9OH;
CH3 - О - C2H5 và C2H3 - О - C2H5
Các cặp chất là đồng phân của nhau : CH3-O-C2H5 và C3H7OH;
C2H5-O-C2H5 và C4H9OH.


Đáp án B
1-không tạo đơn chất.
2-tạo đơn chất S nhưng mà ở dạng rắn.
3-tạo đơn chất là khí N2.
4-tạo đơn chất là khí Cl2.
5-tạo đơn chất là khí H2.
6-tạo đơn chất là P.
7-tạo đơn chất là N2.
8-tạo ra MgO và Si hoặc MgO và Mg2Si