Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong ba hình trên thì cục than ở bình 1 cháy lâu hơn cục than ở bình 2 và cục than ở bình 2 cháy lâu hơn ở bình 3.
Vì lượng oxi trong 3 bình là như nhau.

Chọn A.
Các phản ứng oxi hóa khử là:
(2): 3 C O + F e 2 O 3 → 2 F e + 3 C O 2
(3): 2 M g + C O 2 → 2 M g O + C
(4): 2 F e + 3 C l 2 → 2 F e C l 3

1)
mC = 5000*0.9 = 4500 (g)
nC = 4500/12 = 375 (mol)
C + O2 -to-> CO2
375__375
Vkk = 5VO2 = 375*22.4*5 = 42000(l)
2)
nP = 6.2/31 = 0.2 (mol)
nO2 = 8.96/22.4 = 0.4 (mol)
4P + 5O2 -to-> 2P2O5
0.2___0.25_____0.1
mP2O5 = 0.1*142=14.2 (g)

PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Ta có: \(\left\{{}\begin{matrix}n_C=\dfrac{2,4}{12}=0,2\left(mol\right)\\n_{O_2}=\dfrac{36}{32}=1,125\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Oxi còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,2\left(mol\right)\\n_{O_2\left(dư\right)}=0,925\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CO_2}=0,2\cdot44=8,8\left(g\right)\\V_{khí}=V_{O_2\left(dư\right)}+V_{CO_2}=\left(0,2+0,925\right)\cdot22,4=25,2\left(l\right)\end{matrix}\right.\)

Đốt sắt trong bình khí oxi? Tại sao khi làm TN này phải cuộn 1 mẩu than nhỏ vào đầu lò xo sắt và đáy bình phải cho 1 ít cát hoặc nước?
3Fe + 2O2 –to> Fe3O4
- Hiện tượng: Sắt cháy mạnh, sáng chói, tạo các hạt chất rắn nhỏ nóng màu nâu
- Mẩu than đóng vai trò cháy trước tạo nhiệt độ đủ lớn cho sắt cháy
Các hạt chất rắn nóng chảy đó có nhiệt độ rất cao, khi tiếp xúc bình thủy tinh có thể làm vỡ, nứt bình. Rải 1 lớp cát hoặc nước sẽ giúp ngăn cách, bình không bị vỡ
Đốt đồng trong khí oxi
2Cu + O2 –to> 2CuO
- Hiện tượng: Đồng từ màu đỏ chuyển sang màu đen do đồng II oxit (CuO) được tạo thành.
- Vì đốt Cu trong không khí nên Oxi dư => tạo ra CuO
Trình bày thí nghiệm xác định thành phần không khí? Có thể thay P bằng C hoặc S được không? Vì sao?
4P + 5O2 -to> 2P2O5
- Đốt 1 lượng Photpho trong muỗng sắt, khi Photpho cháy mãnh liệt thì cho vào 1 bình hình trụ đều hở 2 đầu. Sau khi cho Photpho vào thì bịt nắp lại. Ta thấy mực nước trong bình dâng lên khoảng 1/5 thể tích bình, nên ta kết luận Oxi chiếm 1/5 thành phần không khí
- Không vì khi đốt cháy C và S sẽ sinh ra khí CO2, SO2 sẽ làm thay đổi thành phần không khí.
Lấy photpho vào muỗng sắt, đốt cháy trong không khí sau đó đưa vào bình đựng khí oxi, phản ứng cháy kết thúc cho nước vào bình lắc đều và thử dung dịch tạo thành bằng giấy quỳ.
- Photpho cháy trong không khí tạo ra P2O5
4P + 5O2 -to> 2P2O5
- Khi cho P2O5 vào nước, sẽ tạo thành H3PO4 là dung dịch axit nên khi nhúng quỳ tím sẽ đổi sang màu đỏ
Trong phòng thí nghiệm khí oxi được điều chế và thu khí như thế nào? Làm thế nào để thử độ tinh khiết và thu được khí oxi hoàn toàn tinh khiết?Nêu hiện tượng xảy ra và giải thích
- Trong phòng thí nghiệm cách người ta hay dung nhất là đốt cháy KMnO4
KMnO4 –to> MnO2 + O2 + K2MnO4
- Sau khi đốt cháy KMnO4 người ta sẽ thu O2 bằng pp đẩy nước vì oxi ít tan trong nước
- Để thu được khí Oxi tinh khiết thì sẽ cho hỗn hợp khí đi qua dung dịch, hợp chất tác dụng được với tạp chất để thu được khí Oxi tinh khiết (VD như khí CO2, SO2 thì dùng dung dịch CaCO3, Cl2 thì dùng dung dịch AgNO3, …)
- Hình như thử Oxi tinh khiết thì chỉ có thể thử bằng máy thôi :v mình không chắc lắm

Bạn tham khảo tại đây nhé
https://sites.google.com/site/hoahocquan10/bai-tap/bai-tap-hoa-8/hoa-8-chuong-iv

a) Lưu huỳnh cháy nhanh tạo thành ngọn lửa sáng rực sinh ra nhiều khói trắng.
\(S+O_2\underrightarrow{t^0}SO_2\)
b) Photpho cháy trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ.
\(4P+5O_2\underrightarrow{t^0}2P_2O_5\)
c) Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, hay còn gọi là oxit sắt từ.
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
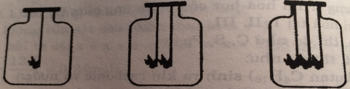
Bình 1: than cháy lâu nhất
-Bình 3: than cháy nhanh nhất
-Bình 2: cháy nhanh hơn bình 1 và chậm hơn bình 3