Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhỏ từ từ $HCl$ vào 3 mẫu thử. Lọ nào không xuất hiện khí ngay chứa $Na_2CO_3$ và $K_2SO_4$. Hai lọ còn lại tạo khí ngay lập tức
Nhỏ $BaCl_2$ vào hai lọ còn lại tới khi thấy kết tủa không tăng thì đem nhỏ $HCl$ tới dư. Lọ nào vẫn cho kết tủa thì chứa $KHCO_3$ và $Na_2SO_4$
Lọ còn lại chứa $K_2CO_3$ và $NaHCO_3$
Trích mẫu thử
Cho từ từ dd HCl vào mẫu thử
- MT xuất hiện khí ngay là $KHCO_3$ và $Na_2SO_4$
- MT sau một thời gian mới xuất hiện khí là $K_2CO_3$ và $NaHCO_3$ ; $Na_2CO_3$ và $K_2SO_4$
Cho dung dịch $BaCl_2$ tới dư vào hai mẫu thử còn. Sau đó thêm lượng dư dung dịch $HCl$
- MT nào tạo kết tủa rồi tan hết là $K_2CO_3,NaHCO_3$
- MT nào không tan hoàn toàn là $Na_2CO_3,K_2SO_4$
$K_2CO_3 + HCl \to KCl + KHCO_3$
$NaHCO_3 + HCl \to NaCl + CO_2 + H_2O$
$KHCO_3 + HCl \to KCl + CO_2 + H_2O$
$Na_2CO_3 + HCl \to NaCl + NaHCO_3$
$BaCl_2 +K_2CO_3 \to BaCO_3 + 2KCl$
$BaCl_2 + K_2SO_4 \to BaSO_4 + 2KCl$
$BaCO_3 + 2HCl \to BaCl_2 + CO_2 + H_2O$

Trong V ml dung dịch $K_2CO_3$ 10% có D = 1,25(g/ml), ta có :
$m_{dd} = 1,25V(gam)$
$m_{K_2CO_3} = 1,25V.10\% = 0,125V(gam)$
Sau khi trộn :
$m_{dd} = 1,25V + 150(gam)$
$m_{K_2CO_3} = 0,125V + 150.4\% = 0,125V + 6(gam)$
Suy ra :
$\dfrac{0,125V + 6}{1,25V + 150} = \dfrac{6,4}{100}$
$\Rightarrow V = 80(ml)$

*Tham khảo:
- Na2S là muối của natri và lưu huỳnh, có công thức hóa học là Na2S. Nó tồn tại dưới dạng bột màu trắng và tan trong nước. Na2S có mùi hắc và độc, được sử dụng trong công nghiệp để sản xuất các hợp chất lưu huỳnh khác.
- Na2SO3 là muối của natri và axit sulfurous, có công thức hóa học là Na2SO3. Nó tồn tại dưới dạng bột màu trắng và tan trong nước. Na2SO3 có tính khử mạnh và được sử dụng trong công nghiệp thực phẩm để làm chất chống oxy hóa và chất bảo quản.
- K2SO4 là muối của kali và axit sulfuric, có công thức hóa học là K2SO4. Nó tồn tại dưới dạng bột màu trắng và tan trong nước. K2SO4được sử dụng trong nông nghiệp như một nguồn cung cấp kali và lân cho cây trồng.
- K2CO3là muối của kali và axit cacbonic, có công thức hóa học là K2CO3 Nó tồn tại dưới dạng bột màu trắng và tan trong nước. K2 CO3 được sử dụng trong công nghiệp hóa chất và sản xuất thuốc nhuộm, thuốc tẩy và thuốc nhuộm.

Gọi số nguyên tử của \(Al_2(SO_4)_3\) và \(K_2SO_4\) lần lượt là x và y.
Số nguyên tử của \(Al_2(SO_4)_3\) là \(2+3+4\cdot3=17x\)
Số nguyên tử của \(K_2SO_4\) là \(2+1+4=7y\)
Mà số nguyên tử \(O_2\) trong hỗn hợp là \(4\cdot3x+4y=12x+4y\)
Theo bài: \(n_{O_2}=\dfrac{20}{31}n_{hh}\)
\(\Rightarrow12x+4y=\dfrac{20}{31}\left(17x+7y\right)\)
\(\Rightarrow y=2x\)
Có \(\%m_{Al_2\left(SO_4\right)_3}=\dfrac{342x}{342x+174y}\cdot100\%=\dfrac{342x}{342x+174\cdot2x}\cdot100\%=49,56\%\)
\(\%m_{K_2SO_4}=100\%-49,56\%=50,44\%\)
\(\%m_{\dfrac{O}{Nhôm.sunfat}}=\dfrac{4.16.3}{342}.100\approx56,14\%\\ \%m_{\dfrac{O}{Kali.sunfat}}=\dfrac{4.16}{174}.100\approx36,78\%\\ Gọi:a=n_{Al_2\left(SO_4\right)_3};b=n_{K_2SO_4}\left(a,b>0\right)\\ \Rightarrow Vì:m_{\dfrac{O}{hh}}=\dfrac{20}{31}\\ \Leftrightarrow\dfrac{a.12+b.4}{17a+7b}.100\%=\dfrac{20}{31}\\ \Leftrightarrow32a=16b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{16}{32}=\dfrac{1}{2}\\ \Leftrightarrow b=2a\\ \%m_{\dfrac{K_2SO_4}{hh}}=\dfrac{174.2a}{174.2a+342.a}.100\%\approx50,435\%\\ \Rightarrow\%m_{\dfrac{Al_2\left(SO_4\right)_3}{hh}}\approx49,565\%\)

PTHH :
\(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\uparrow\)
x 2x 2x x x
\(K_2CO_3+2HCl\rightarrow2KCl+H_2O+CO_2\uparrow\)
y 2y 2y y y
Ta có :
106x + 138y = 26
2x + 2y = 0,4
Giải hệ PT, ta có :
\(\rightarrow x=0,05\left(mol\right);y=0,15\left(mol\right)\)
Thu đc khí CO2 chứ bạn nhỉ?
\(a,V_{CO_2}=\left(0,05+0,15\right).22,4=4,48\left(l\right)\)
\(b,m_{muối}=0,05.58,5+0,15.74,5=14,1\left(g\right)\)
\(c,\%m_{Na_2CO_3}=\dfrac{0,05.106}{26}.100\%\approx20,38\%\)
\(\%m_{K_2CO_3}=100\%-20,38\%=79,62\%\)

a)
_Trích mẫu thử, đánh STT_
Cho các mẫu thử lần lượt tác dụng với dd AgNO3, sau đó nhúng QT:
- Có kết tủa màu trắng, QT hoá đỏ: HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
- Có kết tủa màu đen, QT không đổi màu: NaOH
\(2AgNO_3+2NaOH\rightarrow2NaNO_3+Ag_2O\downarrow+H_2O\)
- Có kết tủa màu trắng, QT không đổi màu: K2SO4
\(2AgNO_3+K_2SO_4\rightarrow Ag_2SO_4\downarrow+2KNO_3\)
- Có kết tủa màu vàng cam: K2CO3
\(2AgNO_3+K_2CO_3\rightarrow Ag_2CO_3\downarrow+2KNO_3\)
_Dán nhãn_
b)
_Trích mẫu thử, đánh STT_
Hoà các mẫu thử vào nước, sau đó nhúng QT:
- Tan, QT hoá đỏ: HCl
- Tan, QT hoá xanh: Ba(OH)2
- Không tan: CaCO3
- Tan, QT không đổi màu: KNO3
_Dán nhãn_
trích 1 ít dung dịch ra làm mẫu thử rồi đánh stt
rồi nhỏ vài giọt vào QT
QT hóa xanh => NaOH
QT hóa đỏ => HCl
QT không đổi màu => K2SO4 , K2CO3
cho HCl tác dụng với 2 mẫu thử còn lại
có khí => K2CO3
không hiện tượng => K2SO4
dán nhãn
b) trích 1 ít dung dịch ra làm mẫu thử rồi đánh stt
rồi nhỏ vài giọt vào QT
QT hóa xanh => Ba(OH)2
QT hóa đỏ => HCl
QT không đổi màu => CaCO3 , KNO3
cho 2 dung dịch vào nước cất
tan => KNO3
không tan => CaCO3
dán nhãn
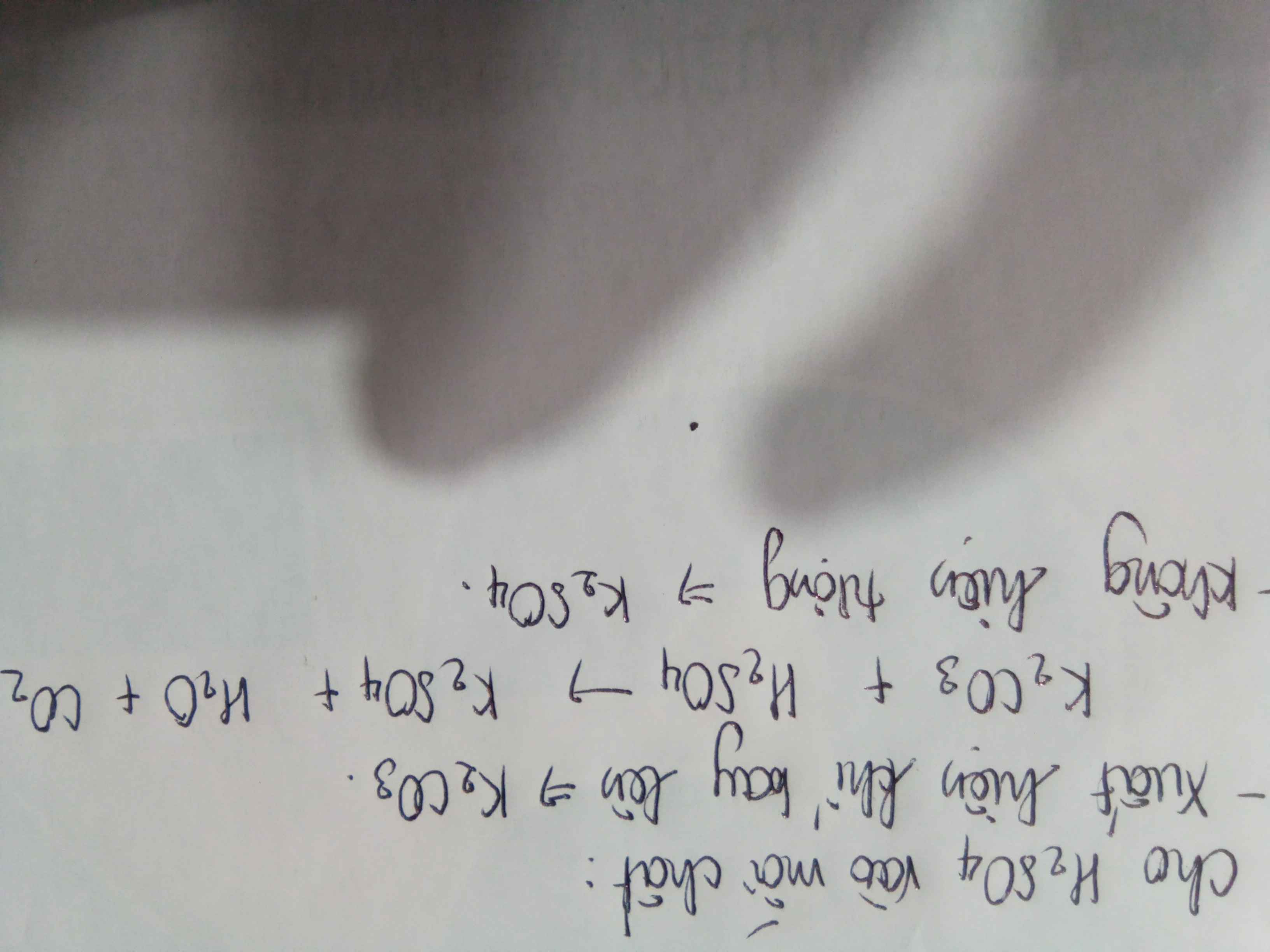
\(n_{K_2CO_3}=\dfrac{150.13,8\%}{100\%.138}=0,15(mol)\\ n_{K_2SO_4}=\dfrac{150.34,8\%}{100\%.174}=0,3(mol)\)
\(n_{K_2CO_3}=\dfrac{150.13,8}{100.138}=0,15\left(mol\right)\)
\(n_{K_2SO_4}=\dfrac{150.34,8}{100.174}=0,3\left(mol\right)\)