Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
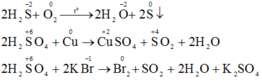

a)H2S chỉ thể hiện tính khử vì số oxi hóa của S ở mức thấp nhất :-2 .(Không thể giảm nên chỉ có tình khử)
H2SO4 chỉ thể hiện tính oxi hóa vì số oxi hóa của S ở mức cao nhất :6 . (Không thể tăng nên chỉ có tính oxi hóa)
b)H2S + Pb(NO3)2-->PbS + 2HNO3
H2SO4+ FeS -->H2S + FeSO4

F trong phân tử F2 có số oxi hóa là 0, có khả năng nhận 1 e để chuyển sang trạng thái oxi hóa -1 → tính oxi hóa.
Đáp án: A

A với c: S có cả tính khử và tính oxi hóa
B với d: SO2 là chất khí có tính oxi hóa và tính khử
C với b: H2S chỉ có tính khử
D với a: H2SO4 chỉ có tính oxi hóa

Chọn đáp án A
A. F2. Trong các hợp chất chỉ có số OXH – 1 nên chỉ có tính OXH
B. AgBr. Vừa thể hiện tính khử và OXH 2 AgBr → anh sang 2 Ag + Br 2
C. H2O. Thể hiện tính khử F 2 + H 2 O → 2 HF + 1 / 2 O 2
D. Cl2. Clo có thể xuống – 1 và nên các số OXH như +1,+3...

Chọn đáp án B
1. Đúng.
2. Sai.HF là axit rất yếu.Ăn mòn thủy tinh là tính chất riêng có.
3. Sai.Tính khử và tính axit tăng dần
4. Sai điều chế bằng điện phân dung dịch NaCl không có màng ngăn.
5. Sai HClO là axit rất yếu

C. Tính khử và tính oxi hóa
C. Tính khử và tính oxi hóa