Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TCHH của muối:
- Tác dụng với kim loại
PTHH: Mg + 2 HCl -> MgCl2 + H2
Zn + H2SO4 (loãng) -> ZnSO4 + H2
Cu + 2 H2SO4(đ) -to-> CuSO4 + SO2 + 2 H2O
2 Fe + 6 H2SO4(đ) -to-> Fe2(SO4)3+ 3 SO2 + 6 H2O
Fe + 2 HCl -> FeCl2 + H2
- Tác dụng với axit:
HCl + AgNO3 -> AgCl + HNO3
H2SO4 + BaCl2 -> BaSO4 + 2 HCl
CaCO3 + 2 HCl -> CaCl2 + CO2 + H2O
BaCO3 + 2 HCl -> BaCl2 + CO2 + H2O
MgCO3 +2 HCl -> MgCl2 + CO2 + H2O
- Tác dụng với dd bazo:
Na2CO3 + Ca(OH)2 -> CaCO3 + 2 NaOH
CuSO4 + 2 NaOH -> Cu(OH)2 + Na2SO4
BaCl2 + 2 AgNO3 -> Ba(NO3)2 + 2 AgCl
CuSO4 + Ba(OH)2 -> BaSO4 + Cu(OH)2
CuCl2 + 2 KOH -> 2 KCl + Cu(OH)2
- Tác dụng vơi dd muối:
CuCl2 + 2 AgNO3 -> 2 AgCl + Cu(NO3)2
BaCl2 + Na2SO4 -> 2 NaCl + BaSO4
CaCl2 + Na2CO3 -> 2 NaCl + CaCO3
CuSO4 + BaCl2 -> BaSO4 + CuCl2
Al2(SO4)3 + 3 Ba(NO3)2 -> 3 BaSO4 + 2 Al(NO3)3
- Phản ứng phân hủy muối:
CaCO3 -to-> CaO + CO2
2 KMnO4 -to-> K2MnO4 + MnO2 + O2
2 KClO3 -to-> 2 KCl + 3 O2
MgCO3 -to-> MgO + CO2
Cu(NO3)2 -to-> CuO + 2 NO2 + 1/2 O2
Chúc em học tốt!

PTHH biểu diễn tính chất hóa học của cacbon và một số hợp chất khác:
(1) C(r) + CO2 (k) 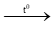
(2) C(r) + O2 (k) 
(3) CO + CuO 
(4) CO2 (k) + C(r) 
(5) CO2 (k) + CaO(r) 
(6) CO2(k) + 2NaOH(dd) dư → Na2CO3 (r) + H2O(l)
CO2 (k) + NaOH (dd) đủ → NaHCO3
(7) CaCO3 (r) 
(8) Na2CO3(r) + 2HCl(dd) → 2NaCl(dd) + CO2(k)↑ + H2O(l)
NaHCO3 (r) + HCl (dd) → NaCl(dd) + CO2(k) + H2O(l)
Vai trò của C trong phản ứng (1), (2) và (4) là chất khử (chất chiếm oxi).

(1) C + CO2 to→ 2CO (2) 3C + Fe2O3 to→ 2Fe + 3CO (3) 3C + CaO to→ CaC2 + CO (4) C + 2PbO to→ 2Pb + CO2 (5) C + 2CuO to→ 2Cu + CO2
Trong các phản ứng trên C là chất khử

Tỉ lê số mol H 2 O và CO 2 sinh ra khi đốt cháy CH 4 là n H 2 O / n CO 2 = 2
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Tỉ lệ số mol H 2 O và CO 2 sinh ra khi đốt cháy C 2 H 4 là : n H 2 O / n CO 2 = 1
C 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O
Tỉ lệ số mol H 2 O và CO 2 sinh ra khi đốt cháy C 2 H 2 là: n H 2 O / n CO 2 = 1/2
C 2 H 2 + 5/2 O 2 → 2 CO 2 + H 2 O

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
2Cu+O2to→2CuO2Cu+O2→to2CuO
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
O2+2H2to→2H2OO2+2H2→to2H2O
+ Tác dụng với một số phi kim khác:
4P+5O2to→2P2O54P+5O2→to2P2O5
+ Tác dụng với một số hợp chất:
C2H5OH+3O2to→2CO2+3H2OC2H5OH+3O2→to2CO2+3H2O
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3to→3O2↑+2KCl

- Trích một ít các chất làm mẫu thử:
+ Dẫn các khí qua dd Br2 dư:
* Không hiện tượng: CO2, CH4 (1)
* dd nhạt màu dần: C2H4
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
+ Dẫn các khí còn lại ở (1) qua dd Ca(OH)2 dư:
* Không hiện tượng: CH4
* Kết tủa trắng: CO2
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
-
a) C2H4 + 3O2 --to--> 2CO2 + 2H2O
b) \(n_{C_2H_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(n_{CO_2}=0,6\left(mol\right)\)
=> \(m_{CO_2}=0,6.44=26,4\left(g\right)\)
c)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,6------->0,6
=> \(m_{CaCO_3}=0,6.100=60\left(g\right)\)

a: \(C+O_2\rightarrow CO_2\)(ĐK: t độ)
x x x
\(S+O_2\rightarrow SO_2\)(ĐK: t độ)
y y y
b: \(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
Theo đề, ta có hệ:
12x+32y=10 và x+y=0,5
=>x=0,3 và y=0,2
\(m_C=0.3\cdot12=3.6\left(g\right)\)
\(m_S=0.2\cdot32=6.4\left(g\right)\)
c: \(n_{CO_2}=n_C=0.3\left(mol\right)\)
\(n_{SO_2}=n_S=0.2\left(mol\right)\)
\(V_{khí}=22.4\left(0.3+0.2\right)=11.2\left(lít\right)\)
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH :
\(C+O_2\rightarrow\left(t^o\right)CO_2\)
x x x
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
y y y
Gọi n C = x
n S = y (mol)
Ta có hệ PT :
\(\left\{{}\begin{matrix}12x+32y=10\\x+y=0,5\end{matrix}\right.\)
\(\rightarrow x=0,3;y=0,2\)
\(m_C=0,3.12=3,6\left(g\right)\)
\(m_S=0,2.32=6,4\left(g\right)\)
\(c,V_{hhk}=\left(0,3+0,2\right).22,4=11,2\left(l\right)\)
 Sơ đồ 3
Sơ đồ 3
`TÍNH CHẤT CỦA CACBON
a, Tính hấp phụ
- Cho dd màu đi qua lớp bột than thu được dd không màu
-----> cacbon có tính hấp phụ
b, tính chất hóa học: là một phi kim hoạt động yếu
- pư với o2
c + o2 --> co2
c, tính khử
C + oxit KL ----> KL + CO2\
VD C + CuO ---> Cu + CO2
TÍNH CHẤT CỦA CO2
a,Tính chất vật lí: là khí không màu, không mùi và có vị chua nhẹ hòa tan tốt ở trong nước, nặng gấp 1,524 lần không khí.
hóa lỏng tại nhiệt độ -78 độ C
b, Tính chất hóa học
-) Tác dụng với H2O
CO2 + H2O <---> H2CO3
-) Tác dụng với dd bazơ
CO2 + Ba(OH)2 ---> BaCO3 + H2O
-) Tác dụng với oxit KL ( Li -> Ca) ---> Muối
CO2 + CaO ----> CaCO3