Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Y, Z đều làm mất màu dung dịch Br2 mà từ Z có thể điều chế axit axetic bằng 2 phản ứng nên Z là CH2=CH2 hoặc CH≡CH
TH1: Z là CH2=CH2, Y là CH≡CH, X là CH3-CH3
PTHH:
CH≡CH + 2Br2 → CHBr2-CHBr2
CH2=CH2 + Br2 → CH2Br-CH2Br
CH2=CH2 + H2O → 80 ∘ C H g S O 4 , H 2 S O 4 CH3-CH2-OH
CH3-CH2-OH + O2 → m e n g i a m CH3COOH + H2O
TH2: Z là CH≡CH, Y là CH2=CH2, X là CH3-CH3
CH≡CH + 2Br2 → CHBr2-CHBr2
CH2=CH2 + Br2 → CH2Br-CH2Br
CH=CH + H2O → 80 ∘ C H g S O 4 , H 2 S O 4 CH3CHO
CH3CHO + O2 → x t , t ∘ CH3COOH

Trong 2 nguyên tử X,Y ta có :
\(\left\{{}\begin{matrix}2Z+N=58\\Z+N=39\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z=19\\N=20\end{matrix}\right.\)
Mặc khác, theo đề ta có :
\(\left\{{}\begin{matrix}Z_X+Z_Y=19\\2Z_X-2Z_Y=6\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z_X=11=P_X\\Z_Y=8=P_Y\end{matrix}\right.\)

\(Na_2SO_4+Ba\left(NO_3\right)_2\rightarrow BaSO_{4\downarrow}+2NaNO_3\)
\(Na_2CO_3+Ba\left(NO_3\right)_2\rightarrow BaCO_{3\downarrow}+2NaNO_3\)
\(Na_2SO_3+Ba\left(NO_3\right)_2\rightarrow BaSO_{3\downarrow}+2NaNO_3\)
\(Na_2CrO_4+Ba\left(NO_3\right)_2\rightarrow BaCrO_{4\downarrow}+2NaNO_3\)
\(2Na_3PO_4+3Ba\left(NO_3\right)_2\rightarrow Ba_3\left(PO_4\right)_2+6NaNO_3\)

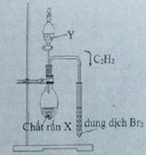
Chọn X: H2 ; Y : O2 ; Z: C2H2
Zn + 2HCl → ZnCl2 + H2
2KMnO4 →K2MnO4 + MnO2 + O2
CaC2 + 2H2O → Ca(OH)2 + C2H2

(X, Y) = (CaC2; H2O)
CH≡CH + Br2 → CH(Br2)–CH(Br2)
Dung dịch Br2 nâu đỏ dần nhạt màu rồi mất màu hoàn toàn

Hỗn hợp khí Y gồm NO2 và O2, khi dẫn hỗn hợp qua dung dịch NaOH thì chỉ có NO2 phản ứng, thể tích dung dịch giảm là thể tích NO2
=> nO2 (trong Y) = 1,2/6 = 0,2 mol
Gọi R là công thức trung bình của Cu và kim loại M, ta có phản ứng nhiệt phân
2R(NO3)2 = 2RO + 4NO2 + O2
nR(NO3)2 = 2nO2 = 2.0,2 = 0,4 mol
=> R(NO3)2 = 93,1/0,4 = 232,75g => R = 108,75g
Ta có : Cu < 108,75 < M
Mặt khác M nằm trong khoảng từ Mg tới Cu trong dãy hoạt động hóa học và M có hóa trị II
=> M = 207g (Pb)