Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

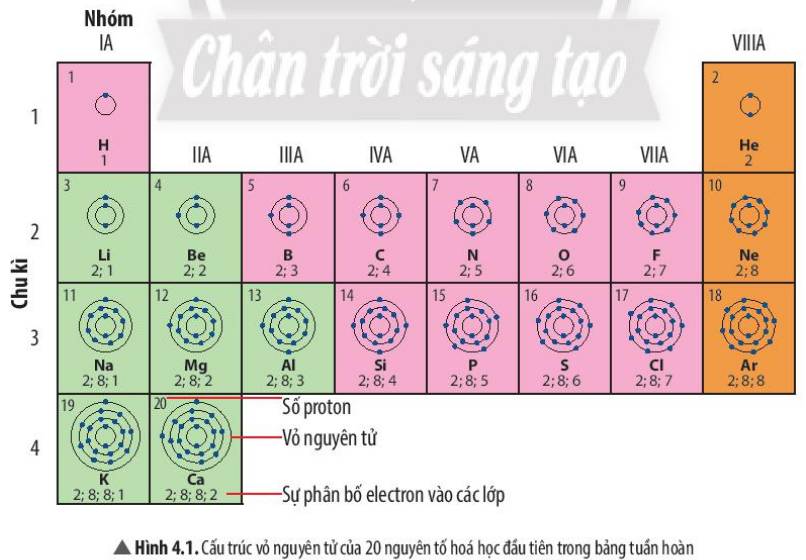
1. Nguyên tử nguyên tố H , nguyên tử nguyên tố He có 1 lớp e
Nguyên tử nguyên tố Li, Be, C, N có 2 lớp e.
2. STT chu kì của nguyên tử nguyên tố H, He (1) < STT chu kì của nguyên tử nguyên tố Li, Be, C, N (2)

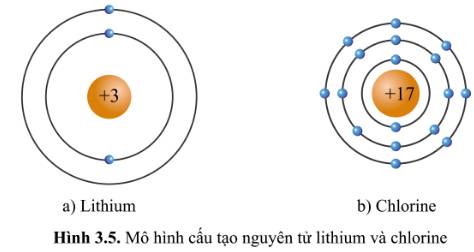
- Xét mô hình cấu tạo của nguyên tử lithium: có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp vỏ ngoài cùng => Thuộc nhóm IA
- Xét mô hình cấu tạo của nguyên tử chlorine: có 7 hình tròn xanh ở vòng tròn ngoài cùng => Có 7 electron ở lớp vỏ ngoài cùng => Thuộc nhóm VIIA

a)
1 lớp:H,He
2 lớp:Li, Be, B, C, N, O, F
3 lớp:Na, Mg, Al, Si, P, S, Cl, Ar
4 lớp:K,Ca
b)
1 e ngoài cùng:H, Li, Na, K
2 e ngoài cùng:Be, Mg, Ca
3 e ngoài cùng:B, Al

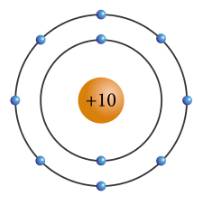
a: X có 10electron và có 2 lớp electron
b: X là neon
c: Oxy, Nitơ,cacbon

1.
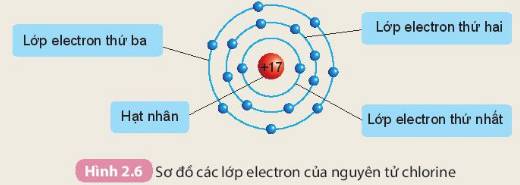
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
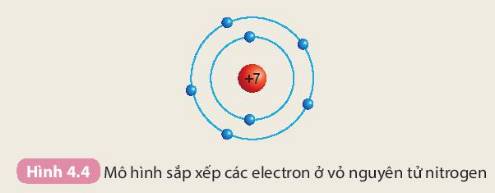
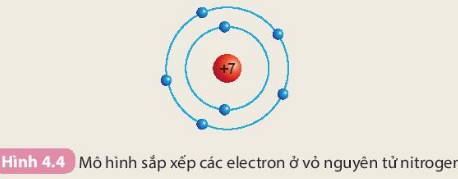
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron

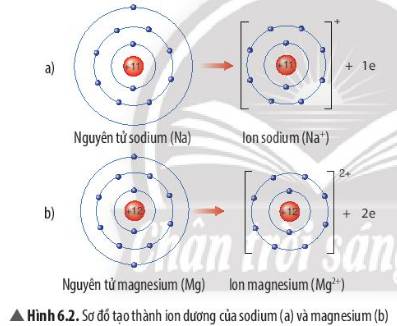
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)

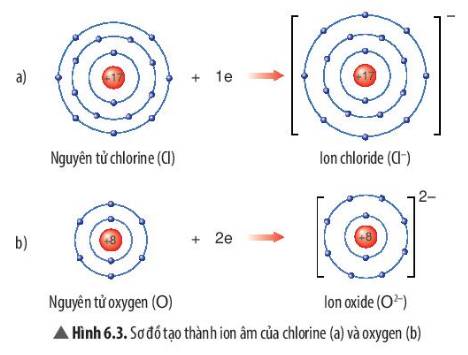
- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)

- Số electron dùng chung của nguyên tử H và O là 4
- Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He

a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8


1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố