Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
Khối lượng dung dịch giảm gồm CuCl2: 0,075 mol và CuO : 14,125−0,075.(64+71)/80 = 0,05 mol
Dung dịch Y chứa CuSO4 : 0,2- 0,075- 0,05 = 0,075 mol, H2SO4 : 0,125 mol ( bảo toàn nhóm SO42−
Khi cho 15 gam bột Fe thì xảy ra phản ứng
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Khối lượng chất rắn thu được gồm Cu : 0,075 mol và Fe dư: 15- 0,075. 56- 0,125. 56 = 3,8 gam → m = 0,075. 64 +3,8 = 8,6 gam

Chọn đáp án B
Nhận thấy bên anot điện phân Cl- trước rồi đến H2O
Bên catot điện phân Cu2+ rồi đến H2O
Khối lượng dung dịch giảm gồm CuCl2: 0,125 mol và CuO
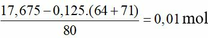
→ dung dịch Y chứa Cu2+ : 0,265 mol và H+ : 0,02 mol, SO42-, Na+
Khi thêm bột Fe xảy ra phản ứng: Fe + 2H+ → Fe2+ + H2 và Fe + Cu2+ → Fe2+ + Cu
Chất rắn thu được gồm Cu: 0,265 mol, Fe dư:
m= 18 - 56.(0,265 + 0,01) + 0,265.64 = 19,56 gam

Đáp án B
Do cho Fe vào X thu được chất rắn => Y có Cu2+ dư tức là Cu2+ chưa bị điện phân hết
Do 0,125.71+0,125.64=16,876<17,625=> Cl- bị điện phân hết, H2O bị điện phân ở anot
Catot: Cu2+ +2e→ Cu
x 2x x
Anot: Cl- -1e→ 0,5Cl2
0,25 0,25 0,125
H2O -2e→ 0,5O2 + 2H+
4y y 4y
+ m dd giảm=mCu+mCl2+mO2=>64x+0,125.71+32y=17,625
+ n e trao đổi=>2x=0,25+4y
=>x=0,135; y=0,005
Vậy Y gồm: Cu2+ dư (0,4-0,135=0,265 mol); H+ (0,02 mol)
nFe>nCu2++2nH+ => Fe dư
Fe +2H+→ Fe2+ + H2
0,01← 0,02
Fe +Cu2+→ Fe2+ + Cu
0,265←0,265 0,265
m chất rắn=mCu+mFe dư=0,265.64+18-0,275.56=19,56 gam












Đáp án A