Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án C
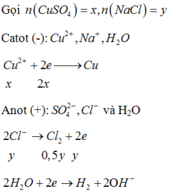
Do dung dịch X là phenol phâtlein hóa hồng nên dung dịch X có MT bazơ nên dung dịch sau phản ứng hòa tan Al2O3 là OH-; (H2O đã điện phân bên catot, còn anot chưa đp H2O)
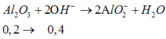
Suy ra n(Cl2) = n (khí anot) = 0,4=0,5y; vậy y=0,8
Bảo toàn e có n(e trao đổi) = 2x+0,4=y=0,8, nên x=0,2
Vậy m = 160.0,2 + 58,5.0,8 = 78,8

Giải thích: Đáp án A
nAl2O3 = 0,1 ; nkhí = 0,15
Dung dịch X hòa tan được Al2O3 => X có môi trường axit hoặc bazo
(*)TH1 : Dung dịch X có môi trường axit
Catot (-) : Cu2+ + 2e -> Cu
Anot (+) : 2Cl- -> Cl2 + 2e
2H2O -> O2 + 4H+ + 4e
Al2O3 + 6H+ -> 2Al3+ + 3H2O
=> nO2 = ¼ nH+= ¼ . 6nAl2O3 = 0,15 mol = nkhí. Tức là Cl- chưa tham gia phản ứng điện phân (Loại)
(*)TH2 : Dung dịch X có môi trường bazo
Catot (-) : Cu2+ + 2e -> Cu
2H2O + 2e -> 2OH- + H2
Anot (+) : 2Cl- -> Cl2 + 2e
Al2O3 + 2OH- -> 2AlO2- + H2O
=> nOH = 2nAl2O3 = 0,2 mol
nCl2 = 0,15 mol => Bảo toàn e : 2nCu + nOH = 2nCl2 => nCu = 0,05 mol
=> nNaCl = nCl = 0,3 mol ; nCuSO4 = nCu2+ = 0,05 mol
=> m = 25,55g

nkhí = 4,48 : 22,4 = 0,2 (mol);
nAl2O3 = 15,3 : 102 = 0,15 (mol)
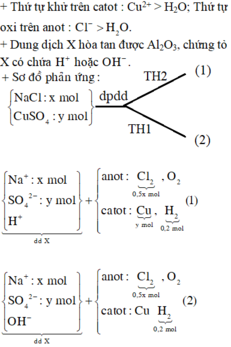
Có thể xảy ra:
Catot:
Cu2+ + 2e → Cu (1)
2H2O + 2e → 2OH- + H2↑ (2)
Anốt
Cl- → Cl2 +2e (3)
2H2O → 4H+ + O2 +4e (4)
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)
Đáp án A

Đáp án A
nkhí = 4,48 : 22,4 = 0,2 (mol); nAl2O3 = 15,3 : 102 = 0,15 (mol)
Có thể xảy ra:
Catot: Anốt
Cu2+ + 2e → Cu (1) Cl- → Cl2 + 2e (3)
2H2O + 2e → 2OH- + H2↑ (2) 2H2O → 4H+ + O2 + 4e (4)
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)

Chọn A.
Vì dung dịch sau phản ứng hòa tan được CuO -> Có H+
Ta có n(H+ = 2n(CuO) = 0,08 mol -> n(O2) = n(H+/4) = 0,02
Mà n(Cl2) + n(O2) = 0,04 -> n(Cl2) = 0,02 mol
Áp dụng định luật bảo toàn nguyên tố Clo -> n(NaCl) = 2n(NaCl) = 0,04 mol
Áp dụng định luật bảo toàn mol e: n(CuSO4) = 4n(O2) + 2n(Cl2))/2 = 0,06
-> m = 0,06∙160 + 0,04∙58,5 = 11,94 gam

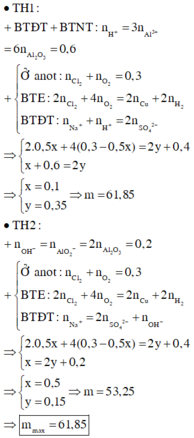

Đáp án C
TH1: Cl- bị đp hết trước Cu2+, H2O ở anot bị điện phân
Al2O3+6H+→2Al3++3H2O
0,2.…1,2
Catot:
Cu2+ + 2e → Cu
Anot:
Cl- -1e → 0,5Cl2
H2O - 2e→0,5O2 + 2H+
0,3 1,2
Ta thấy nO2=0,3 => nCl2 = 0 (vô lí)
TH2: Cu2+ bị điện phân hết trước Cl-, H2O ở catot bị điện phân sinh ra OH-
Al2O3+2OH-→2AlO2-+H2O
0,2…….0,4
Catot:
Cu2+ +2e→Cu
x 2x
H2O+1e→OH-+0,5H2
0,4 0,4
Anot:
Cl- -1e → 0,5Cl2
0,6...0,3
=>2x+0,4=0,6=>x=0,1 mol
=>nCuSO4=0,1 mol; nNaCl=0,6 mol
=>m=0,1.160+0,6.58,5=51,1 gam