Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 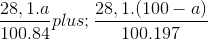 = 0,2
= 0,2
=> a = 29,89.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

- Từ dung dịch AgNO3 có 3 cách để điều chế Ag:
+ Dùng kim loại có tính khử mạnh hơn để khử ion Ag+.
Cu + 2 AgNO3 → Cu(NO3)2 + 2Ag
+ Điện phân dung dịch AgNO3:
4AgNO3 + 2H2O 4Ag + O2 + 4HNO3
+ Cô cạn dung dịch rồi nhiệt phân AgNO3:
2AgNO3 2Ag + 2NO2 + O2
- Từ dung dịch MgCl2 điều chế Mg: chỉ có một cách là cô cạn dung dịch để lấy MgCl2 khan rồi điện phân nóng chảy:
MgCl2 Mg + Cl2.
\(4AgNO_3+2H_2O\) \(\underrightarrow{dpdd}\) \(4Ag+O_2\uparrow+4HNO_3\)
\(2AgNO_3\) \(\underrightarrow{t^o}\) \(2Ag+2NO_2+O_2\)
\(MgCl_2\) \(\underrightarrow{dpnc}\) \(Mg+Cl_2\)

a) Khí nhẹ hơn không khí và cháy được trong không khí là khí H2;
Mg + 2HCl → MgCl2 + H2
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II).
CuO + 2HCl → CuCl2 + H2O
c) Dung dịch có màu vàng nâu là dung dịch muối sắt (III)
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung dịch không có màu là dung dịch muối nhôm.
Al2O3 + 6HCl → 2AlCl3 + 3H2O.

Các cặp chất là đổng đẳng của nhau : C3H7OH và C4H9OH;
CH3 - О - C2H5 và C2H3 - О - C2H5
Các cặp chất là đồng phân của nhau : CH3-O-C2H5 và C3H7OH;
C2H5-O-C2H5 và C4H9OH.

a) Ở nhiệt độ thường:
2KOH + Cl2 \(\rightarrow\) KCl + KClO + H2O
6KOH + 3I2 \(\rightarrow\) 5KI + KIO3 + 3H2O
(Trong môi trường kiềm tồn tại cân bằng : \(\text{3XO- ⇌X- + XO}_3^-\)
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở tất cả các nhiệt độ).
b) Các phương trình hóa học :
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung dịch từ không màu chuyển sang màu vàng nâu :
2FeCl2 + 2KClO + 4HCl \(\rightarrow\) 2FeCl3 + Cl2 + 2KCl + 2H2O
- Khi cho dung dịch Br2 vào dung dịch A, dung dịch brom mất màu :
Br2 + 5KClO + H2O \(\rightarrow\) 2HBrO3 + 5KCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + KClO \(\rightarrow\) H2O + O2 + KCl
- khi cho CO2 vào A
CO2 + KClO + H2O \(\rightarrow\) KHCO3 + HClO

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml
Đáp án D
(a) Đốt dây Mg trong không khí.
(b) Sục khí Cl2 vào dung dịch FeSO4.
(c) Cho dung dịch H2SO4 loãng vào dung dịch Fe(NO3)2.
(d) Cho Br2 vào dung dịch hỗn hợp NaCrO2 và NaOH.