Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa đề là nung KClO3 và KMnO4
\(2KClO_3\left(x\right)\rightarrow2KCl\left(x\right)+3O_2\left(1,5x\right)\)
\(2KMnO_4\left(y\right)\rightarrow K_2MnO_4\left(0,5y\right)+MnO_2\left(0,5y\right)+O_2\left(0,5y\right)\)
Gọi số mol của KClO3 và KMnO4 là x, y
\(\Rightarrow74,5x=98,5y+43,5y\)
\(\Leftrightarrow x=\frac{284}{149}y\)
Ta có: \(\frac{A}{B}=\frac{122,5x}{158y}=\frac{122,5.\frac{284y}{149}}{158y}=1,4778\)
b/ \(\frac{V_1}{V_2}=\frac{1,5x}{0,5y}=\frac{1,5.\frac{284}{149}x}{0,5y}=5,7181\)

Định hướng tư duy giải
Ta có:
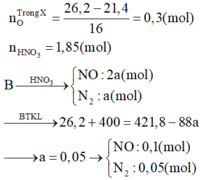

Chất tan trong bình gồm hỗn hợp muối và HNO3 dư.
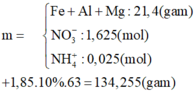

KClO3 ---> KCl + 3/2O2
2KMnO4 ---> K2MnO4 + MnO2 + O2
Gọi x, y tương ứng là số mol của KClO3 và KMnO4.
Sau khi nung các chất còn lại bằng nhau. Theo định luật bảo toàn khối lượng ----> A/B = 1/1 = 1.
A/B = 122,5x/158y = 1 ---> x/y = 158/122,5.
---> VO2(1):VO2(2) = 1,5x/0,5y = 3.x/y = 3,87.

Đáp án C
Ta có: n A l = 0,12 mol
Đem hòa tan các chất thu được bằng Ba(OH)2 dư không tạo thành khí H2 do vậy Al hết, sau phản ứng thu được Al2O3 0,06 mol, Fe và Fe3O4có thể dư.
→ m = 0,06.102+15,68-3,24 = 18,56 gam

HD:
HCl ---> H+ + Cl-
0,2a 0,2a 0,2a
H2SO4 ---> 2H+ + SO42-
0,2b 0,4b 0,2b
Zn + 2H+ ---> Zn2+ + H2
0,3 0,6 0,3 0,3
Theo các pư trên ta có: số mol H+ = 0,2a + 0,4b = 0,6 suy ra: a + 2b = 3. (1)
Mặt khác, khối lượng muối = m(Zn2+) + m(Cl-) + m(SO42-) = 65.0,3 + 35,5.0,2a + 96.0,2b = 43,4. Suy ra: 71a + 192b = 238 (2).
Giải hệ (1) và (2) thu được: a = 2; b = 0,5.

Do khi phản ứng với NaOH tạo khí nên Al dư, oxit sắt hết .
Z là Fe.
2Fe+ 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
=> n Fe = 0,2 mol => n Fe (Z)= 0,8 mol
Lại có n H2 = 0,375 mol
=> nAl (Z) =0,25 mol
=> m Al2O3(Z)= 92,35 – 56.0,8 – 0,25.27 =40,8 g =>B