Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phân tứ và ion xảy ra trong dung dịch :
a) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3\(\downarrow\) + 3Na2SO4
2Fe3+ + 3SO42- + 6Na+ + 6OH- → 2Fe(OH)3\(\downarrow\)+ 6Na+ + 3SO42-
Fe3+ + 3OH- → Fe(OH)3\(\downarrow\)
b) NH4Cl + AgNO3 → NH4NO3 + AgCl↓
NH4 + Cl- + Ag+ + NO3- → NH4+ + NO3- + AgCl↓
Cl- + Ag+ → AgCl↓
c) NaF + HCl → NaCl + HF↑
Na+ + F- + H+ + Cl- → Na+ + Cl- + HF↑
F- + H+ → HF\(\uparrow\)
d) Không có phản ứng xảy ra
e) FeS(r) + 2HCl → FeCl2 + H2S ↑
FeS(r) + 2H+ + 2Cl- → Fe2+ + 2Cl- + H2S↑
FeS(r) + 2H+ \(\rightarrow\) Fe2+ + H2S↑
g) HClO + KOH \(\rightarrow\) KClO + H2O
HClO + K+ + OH- \(\rightarrow\) K+ + CIO- + H2O
HClO + OH- \(\rightarrow\) CIO- + H2O.

TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g

Phương trình ion rút gọn :
a) Ca2+ + CO32- → CaCO3 ↓
b) Fe2+ + 2OH- → Fe(OH)2↓
c) HCO3- + H+ → CO2 ↑ + H2O
d) HCO3- + OH- → H2O + CO32-
e) Không có phương trình ion rút gọn.
g) Pb(OH)2(r) + 2H+ → Pb2+ + 2H2O
h) H2PbO2(r) + 2OH- → PbO22- + 2H2O
i) Cu2+ + S2- → CuS↓.

nH+=0,4+0,1.a
nNO3-=0,1a
bạn viết phương trình Mg+H+ +NO3- dưới dạng pt ion
H++NO3 ttuowng đương với HNO3 loãng
rồi bạn sử dụng phương pháp đường chéo, định luật bảo toàn nguyên tố và electron

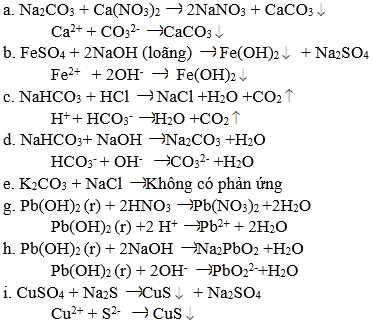
Chọn đáp án B
Các phản ứng hóa học xảy ra:
3Fe2+ +4H+ +NO3- → 3Fe3++NO +2H2O
FeS + 2HCl →FeCl2 + H2S
Si + 2F2 → SiF4
SO2 + H2S → 3S↓ + 2H2O