Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

-\(n_{Fe}=\frac{11,2}{56}=0,2mol\) \(n_{Al}=\frac{m}{27}mol\) |
-khi thêm \(Fe\) vào cốc đựng \(HCl\) ( cốc A ) có phản ứng: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) 0,2 0,2 |
theo định luật bảo toàn khối lượng, khối lượng cốc \(HCl\) tăng thêm: \(11,2-\left(0,2.2\right)=10,8g\) |
khi thêm \(Al\) vào cốc đựng dd \(H_2SO_4\) có phản ứng: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) \(\frac{m}{27}mol\) \(\rightarrow\) \(\frac{3.m}{27.2}mol\) |
| khi cho \(m\) gam \(Al\) vào cốc B, cốc B tăng thêm : \(m-\frac{3.m}{27.2}mol\) |
để cân thăng bằng, khối lượng ở cốc đựng \(H_2SO_4\) cũng phải tăng thêm 10,8g.Có: \(m-\frac{3.m}{27.2}.2=10,8\)
|
| giải ra được \(m=\) \(\left(g\right)\) |

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 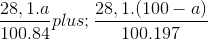 = 0,2
= 0,2
=> a = 29,89.

có phải là cho m (g) al vào cốc đựng dung dịch h2so4 loãng đúng ko?
Fe+ 2HCl -> fecl2+ h2 (1)
2al+ 3h2so4(loãng) -> al2(so4)3 + 3h2 (2)
theo bài ra
nfe= m:M= 11,2: 56= 0,2mol
theo pthh (1) ta có:
nh2= nfe= 0,2 mol
=> mh2= 0,2* 2= 0,4 g
=> khối lượng cốc A tăng là: 11,2 - 0,4= 10,8g
theo bài ra:
nal= m: 27 mol
theo pthh (2)
nh2=(3/2)* nal= (3/2)* (m/27)= m/18 mol
=> mh2 thoát ra : (m/18) *2= m/9 g
=> khối lượng cốc B tăng: m-(m/9)= 8m/9
theo bài ra: 8m/9= 10,8
=> 8m= 97,2
=> m= 12,15 g
nFe= = 0,2 mol
nAl = mol
- Khi thêm Fe vào cốc đựng dd HCl (cốc A) có phản ứng:
Fe + 2HCl ( FeCl2 +H2
0,2 0,2
- Theo định luật bảo toàn khối lượng, khối lượng cốc đựng HCl tăng thêm:
11,2 - (0,2.2) = 10,8g
- Khi thêm Al vào cốc đựng dd H2SO4 có phản ứng:
2Al + 3 H2SO4 ( Al2 (SO4)3 + 3H2(
mol ( mol
- Khi cho m gam Al vào cốc B, cốc B tăng thêm m -
- Để cân thăng bằng, khối lượng ở cốc đựng H2SO4 cũng phải tăng thêm 10,8g. Có: m - = 10,8
- Giải được m = (g)

a) Ở nhiệt độ thường:
2KOH + Cl2 \(\rightarrow\) KCl + KClO + H2O
6KOH + 3I2 \(\rightarrow\) 5KI + KIO3 + 3H2O
(Trong môi trường kiềm tồn tại cân bằng : \(\text{3XO- ⇌X- + XO}_3^-\)
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở tất cả các nhiệt độ).
b) Các phương trình hóa học :
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thoát ra và dung dịch từ không màu chuyển sang màu vàng nâu :
2FeCl2 + 2KClO + 4HCl \(\rightarrow\) 2FeCl3 + Cl2 + 2KCl + 2H2O
- Khi cho dung dịch Br2 vào dung dịch A, dung dịch brom mất màu :
Br2 + 5KClO + H2O \(\rightarrow\) 2HBrO3 + 5KCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + KClO \(\rightarrow\) H2O + O2 + KCl
- khi cho CO2 vào A
CO2 + KClO + H2O \(\rightarrow\) KHCO3 + HClO

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

tính m, hay m1. mà tớ k thấy có m đâu hết cả?
m là khối lượng hỗn hợp hả bạn?
bạn yêu à...chúng ta sẽ giải hệ pt.
viết pt.. 2FeO + 10H2SO4 → Fe2(SO4)3+ 4H20+ SO2
x( mol)=>2x 1/2 x
2 Fe3O4+ 10H2SO4→3Fe2(SO4)3+10H2O+SO2
y(mol)=> 5y 1/2 y
từ đó => hệ{x+y=(224:1000/22.4)/0.5= 0.02
{2x+5y=0,07
=> x=y=0,01......
bạn tự tính tiếp đi nhá
kq: m=3,04 và m1=8( bảo toàn nguyên tố, rồi bảo toàn khối lượng) là ok.....![]()
e xin các anh các chị e đăng bài lên để hỏi chứ k phải để nói chuyện nếu ai muốn nói chuyện thì vao mà kp face vs e

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml

Chọn A.
(a) Dung dịch nhạt dần màu tím.
(b) Dung dịch nhạt dần màu xanh.
(c) Có xuất hiện kết tủa trắng sau đó tan tạo dung dịch thu được trong suốt
(d) Dung dịch nhạt dần màu cam.
(e) Dung dịch chuyển sang màu vàng.
(g) Dung dịch không có sự chuyển màu.