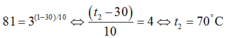Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C nhé
Hg + S ---> HgS (Vì Hg có tính oxi hóa yếu nên tác dụng được với S ở nhiệt độ thường )

Cl 2 + 2KOH → KCl + KClO + H 2 O
3 I 2 + 6KOH → 5KI + KI O 3 + 3 H 2 O
Trong môi trường kiềm, ion XO - phân huỷ theo phản ứng sau :
3 XO - → 2 X - + XO 3 - (kí hiệu X là halogen)
Ion ClO - phân huỷ rất chậm ở nhiệt độ thường, phân huỷ nhanh ở nhiệt độ trên 75 ° C
Ion IO - phân huỷ ở tất cả các nhiệt độ trên, do đó ở nhiệt độ thường, ta có 2 phản ứng trên.

Đặt kim loại A có hóa trị x (x:nguyên, dương)
\(2A+xCl_2\underrightarrow{^{to}}2ACl_x\\ m_{Cl_2}=32,5-11,2=21,3\left(g\right)\\ n_{Cl_2}=\dfrac{21,3}{71}=0,3\left(mol\right)\\ n_A=\dfrac{0,3.2}{x}=\dfrac{0,6}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{11,2}{\dfrac{0,6}{x}}=\dfrac{56}{3}x\\ \Rightarrow Nhận:x=3\Rightarrow M_A=56\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Sắt\left(Fe=56\right)\)

Các yếu tố ảnh hưởng đến tốc độ phản ứng trong mỗi trường hợp đã cho là : V 2 O 5 là chất xúc tác, làm tăng tốc độ phản ứng.

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có
81 = 3 ( 1 - 30 ) / 10 ⇔ ( t 2 - 30 ) 10 = 4 ⇔ t 2 = 70 0 C

Đáp án B
Theo định nghĩa, số lần tăng tốc độ phản ứng khi nhiệt độ thay đổi 100C chính là hệ số nhiệt độ γ.
Suy ra γ = 3.
Gọi nhiệt độ sau khi tăng là t2
Thay vào công thức ta có