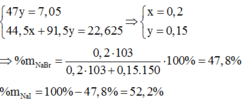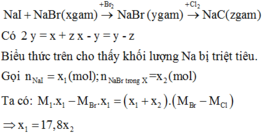Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaBr}=0,2\left(mol\right);n_{NaI}=0,24\left(mol\right)\)
NaI bị oxi hoá trước NaBr
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
Gọi x là mol Cl2 phản ứng
* TH1: dư NaI
\(\Rightarrow\) Tạo 2x mol NaCl; dư 0,24 - 2x mol NaI; 0,2 mol NaBr
\(\Rightarrow58,5.2x+150\left(0,24-2x\right)+103.0,2=38,3\)
\(\Rightarrow x=0,1\left(TM\right)\Rightarrow V=0,1.22,4=2,24\left(l\right)\)
* TH2: NaI vừa hết
\(\Rightarrow\) Tạo 0,24 mol NaCl; dư 0,2 mol NaBr
\(\Rightarrow58,5.0,24+103.0,2=38,3\)
\(\Rightarrow34,52=38,3\) (loại)
* TH3: NaI hết, dư NaBr
\(\Rightarrow\) Tạo 0,24 + 2x - 0,24= 2x mol NaCl; dư 0,2 - 2x + 0,24= 0,44 - 2x mol NaBr
\(\Rightarrow58,5.2x+103.\left(0,44-2x\right)=38,3\)
\(\Rightarrow x=0,079\left(mol\right)\left(TM\right)\Rightarrow V=0,079.22,4=1,7696\left(l\right)\)
* TH4: 2 muối hết
\(\Rightarrow\) Tạo 0,24 + 0,2 = 0,44 mol NaCl
\(\Rightarrow0,44.58,5=38,3\)
\(\Rightarrow25,72=38,3\) (loại)

\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
Ta có: \(n_{NaCl}=\dfrac{2,8665}{58,5}=0,049\left(mol\right)\)
Theo PT: \(n_{NaCl}=n_{NaBr}+n_{NaI}=0,049\left(mol\right)=x\)
Cho hỗn hợp muối có dạng NaX
PTHH : 2NaX + Cl2 -> 2NaCl + X2
Số mol NaCl \(\dfrac{2,866}{23+35,4}=0,05\left(mol\right)\)
-> molNaX = molNaCl = 0,05 mol

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ: