Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
V lớn nhất khi có hiện tượng hòa tan kết tủa
, nOH = nNaOH + nKOH + 2nBa(OH)2 = 0,8 mol
,nBaCO3 = 0,14 mol
=> nCO2 = nOH – nBaCO3 = 0,66 mol
=> V = 14,784 lit

Chọn đáp án C
Tổng nH+ = 0,02 + 0,06 = 0,08 mà có n H C O 3 - = 0,03 và n H C O 3 2 - = 0,06 Þ Tỉ lệ 1: 2
Đặt số mol n H C O 3 - phản ứng = x Þ n H C O 3 2 - phản ứng = 2x Þ x + 2.2x = 0,08
Þ x = 0,08/5 = 0,016
Þ nCO2 = x + 2x = 3x0,016 = 0,048 Þ V = 0,048x22,4 = 1,0752
X lúc này có n S O 4 2 - = 0,06, n B a 2 + = 0,03 - 0,016 = 0,014; n C O 3 2 - = 0,06 - 0,032 = 0,028
Thêm vào X hỗn hợp 0,06 OH- và 0,15 Ba2+ Þ nOH- > n H C O 3 -
Þ Sau phản ứng với OH-, tổng n B a 2 + = 0,014 + 0,028 = 0,042
Vì 0,042 + 0,06 <0,15 Þ Ba2+ dư Þ nBaCO3 = 0,042 và nBaSO4 = 0,06
Vậy m = 0,042x197 + 0,06x233 = 22,254

Đáp án A
![]()
Cho từ từ đến X vào 0,02 ml HCl thu được 0,015 mol khí CO2
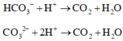
Giải được số mol HCO3- và CO32- phản ứng là 0,1 và 0,05 mol.
Do vậy trong X HCO3- và CO32- có tỉ lệ số mol là 2:1.
Vì còn CO32- nên kết tủa thu được là BaCO3 0,02 mol.
X chứa NaHCO3 và Na2CO3 với số mol lần lượt là 0,02 và 0,01 mol.
![]()

Đáp án A
Khi thêm dung dịch NaOH vào dung dịch X lại thu được kết tủa.
⇒ Có 2 muối HCO3- và CO32-
+ Có nBaCO3 = 0,005 mol < nBa2+ = 0,01 mol.
⇒ Dung dịch X chứa Ba2+ : 0,005 mol, Na+ : 0,01 mol, HCO3- : 0,02
+ Bảo toàn nguyên tố C → nCO2 = nCO32- + nHCO3- = 0,005 + 0,02 = 0,025 mol.
⇒ V = 0,56 lít

Đáp án B
![]()
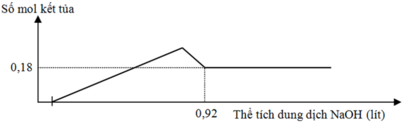
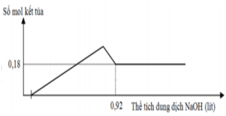
Đồ thị trải qua các giai đoạn:
+Chưa xuất hiện kết tủa do NaOH trung hòa axit dư.
+Kết tủa tăng dần.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3, kết tủa sau cùng chỉ còn lại là Mg(OH)2.
Nhận thấy lúc 0,92 mol NaOH phản ứng thì kết tủa thu được là 0,18 mol Mg(OH)2
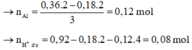
Giải được số mol H2SO4 0,16 mol, HCl 0,48 mol.
Cho V ml Ba(OH)2 0,4M và NaOH 0,8M chứa x mol Ba(OH)2 và 2x mol NaOH.
Để kết tủa hidroxit lớn nhất là 4x=0,08+0,12.3+0,18.2=0,8.
Để kết tủa BaSO4 lớn nhất là x>0,16.
Do vậy thỏa mãn x=0,2 suy ra V=0,5 lít=500ml.



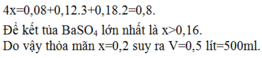
Đáp án C