Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
ne = 0,15 mol; nCl– = 0,2 mol ||⇒ Cl– chưa bị điện phân hết ⇒ nCl2 = 0,075 mol.
Ghép sản phẩm, dễ thấy ghép 0,075 mol CuCl2 thì mgiảm = 10,125(g) > 9,195(g) ⇒ vô lí!.
⇒ sản phẩm gồm CuCl2 và HCl với số mol x và y ⇒ nCl = 2x + y = 0,15 mol.
mgiảm = 135x + 36,5y = 9,195(g) ||⇒ giải hệ có: x = 0,06 mol; y = 0,03 mol.
Do catot đã có điện phân H2O ⇒ a = 0,06 ÷ 0,1 = 0,6M

Dung dịch vẫn còn màu xanh nghĩa là Cu2+ chưa bị điện phân hết.

Đáp án D

Đáp án A
Khối lượng dung dịch giảm gồm CuCl2: 0,075 mol và CuO : 14 , 125 - 0 , 075 . ( 64 + 71 ) 80 = 0,05 mol
Dung dịch Y chứa CuSO4 : 0,2- 0,075- 0,05 = 0,075 mol, H2SO4 : 0,125 mol ( bảo toàn nhóm SO42-)
Khi cho 15 gam bột Fe thì xảy ra phản ứng
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Khối lượng chất rắn thu được gồm Cu : 0,075 mol và Fe dư: 15- 0,075. 56- 0,125. 56 = 3,8 gam.
⇒ m = 0,075. 64 +3,8 = 8,6 gam
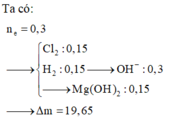
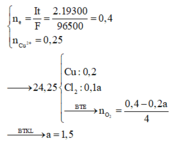
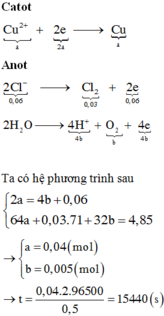



Đáp án A
Ta có phản ứng điện phân:
CuSO4 + H2O → Cu + 0,5O2 + H2SO4.
Với mGiảm = mCu + mO2 <=> 64a + 32×0,5a = 16 <=> a = 0,2.
nCuSO4 = nH2S = 0,1 mol.
⇒ nCuSO4 = nCuSO4 pứ + nH2S = 0,2 + 0,1 = 0,3 mol.
⇒ CM CuSO4 = 0,3÷0,3 = 1M