Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của phản ứng:
3Fe + 2O\(_2\) → Fe\(_3\)O\(_4\).
nFe3O4 = \(\dfrac{2,32}{232}\) = 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
a.
\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe}=0,03.56=1,68g\)
\(m_{O_2}=0,02.32=0,64g\)
b.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,04 0,02 ( mol )
\(m_{KMnO_4}=0,04.158=6,32g\)

1. khí oxi tác dụng được với:
A. CO2, Fe, C
B. Na2O, CH4, H2
C. CaCO3, P, CH4
D. C2H4, C, K
2.Dãy chất dùng để điều chế oxi trong phòng thí nghiệm:
A. Nước, thuốc tím
B. Không khí, nước
C. thuốc tím, kali clorat
D. kali nitrat, nước
3.có thể thu khí hidro bằng cách đẩy nước vì:
A. khí hidro nhẹ hơn ko khí
B. khí hidro tan rất ít trong nước
C. khí hidro tan nhiều trong nước
D. thu khí hidro bằng cách đặt úp ống nghiệm
4.kim loại nào sau đây tác dụng với nước ở nhiệt dộ thường tạo thành dd bazo và khí hidro?
A. Fe B.Mg C. Ba D. Zn
5. đốt cháy chất nào sau đây tạo ra sản phẩm là CO2 và H20?
A. H2 B. P C. Mg D. C3H8
6. chất nào sau đây phản ứng với nước tạo thành bazo?
A.SO3 B. P2O5 C.FeO D. K2O
7. chất nào sau đây phản ứng với nước tạo thành axit?
A. CO2 B. CaO C. FeO D. Na
8.rót nước vào ống nghiệm có chứa một ít vôi sống CaO, cho mẫu quì tím vào dd tạo thành. Hiện tượng quan sát được là:
A. quì tím chuyển sang màu đỏ
B. quì tím chuyển sang màu xanh
C. quì tím bị mất màu
D. quì tím ko bị mất màu
9.dãy kim loại tác dụng được với nước ở điều kiện thường:
A. K, Na, Cu B. Zn, Ca,K C. Ca, Li, Fe D. Li, Ba, K
10. dãy oxit tác dụng được với nước tạo thành dd bazo:
A. PbO, Na2O, CuO
B. ZnO, CaO, K2O
C. BaO, K2O, Fe2O3
D. Na2O, BaO, K2O

a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,03\left(mol\right)\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,02\left(mol\right)\Rightarrow m_{O_2}=0,02.32=0,64\left(g\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,04\left(mol\right)\Rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)

a.\(\%Fe=\dfrac{56.3}{56.3+16.4}.100=72,41\%\)
b.\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,04 0,02 ( mol )
\(m_{O_2}=0,04.32=1,28g\)
c.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,08 0,04 ( mol )
\(m_{KMnO_4}=0,08.158=12,64g\)

a)\(n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,15 0,1 0,05
\(m_{Fe}=0,15\cdot56=8,4g\)
\(m_{O_2}=0,1\cdot32=3,2g\)
b)\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,2 0,1
\(m_{KMnO_4}=0,2\cdot158=31,6g\)
\(a,n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,15<--0,1<----------0,05
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,15.56=8,4\left(g\right)\\m_{O_2}=0,1.32=3,2\left(g\right)\end{matrix}\right.\)
b, PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,2<--------------------------------------0,1
=> mKMnO4 = 0,2.158 = 31,6 (g)

a, Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
THeo PT: \(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow V_{O_2}=0,04.22,4=0,896\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)
a) \(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02\left(mol\right)\).
PTHH : \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Mol : 3 : 2 : 1
Mol 0,04 ← 0,02
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=\left(0,04\right).\left(22,4\right)=0,896\left(l\right)\).
b) Từ phương trình ở câu a \(\Rightarrow n_{O_2}=0,04\left(mol\right)\).
PTHH : \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Mol : 2 : 1 : 1 : 1
Mol : 0,08 ← 0,04
\(\Rightarrow m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=\left(0,08\right).158=12,64\left(g\right)\).

Sửa đề: 4,46 (g) → 4,64 (g)
a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)
b, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)

a, Ta có: \(n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
___0,15__0,1____0,05 (mol)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
________0,2________________________0,1 (mol)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Bạn tham khảo nhé!
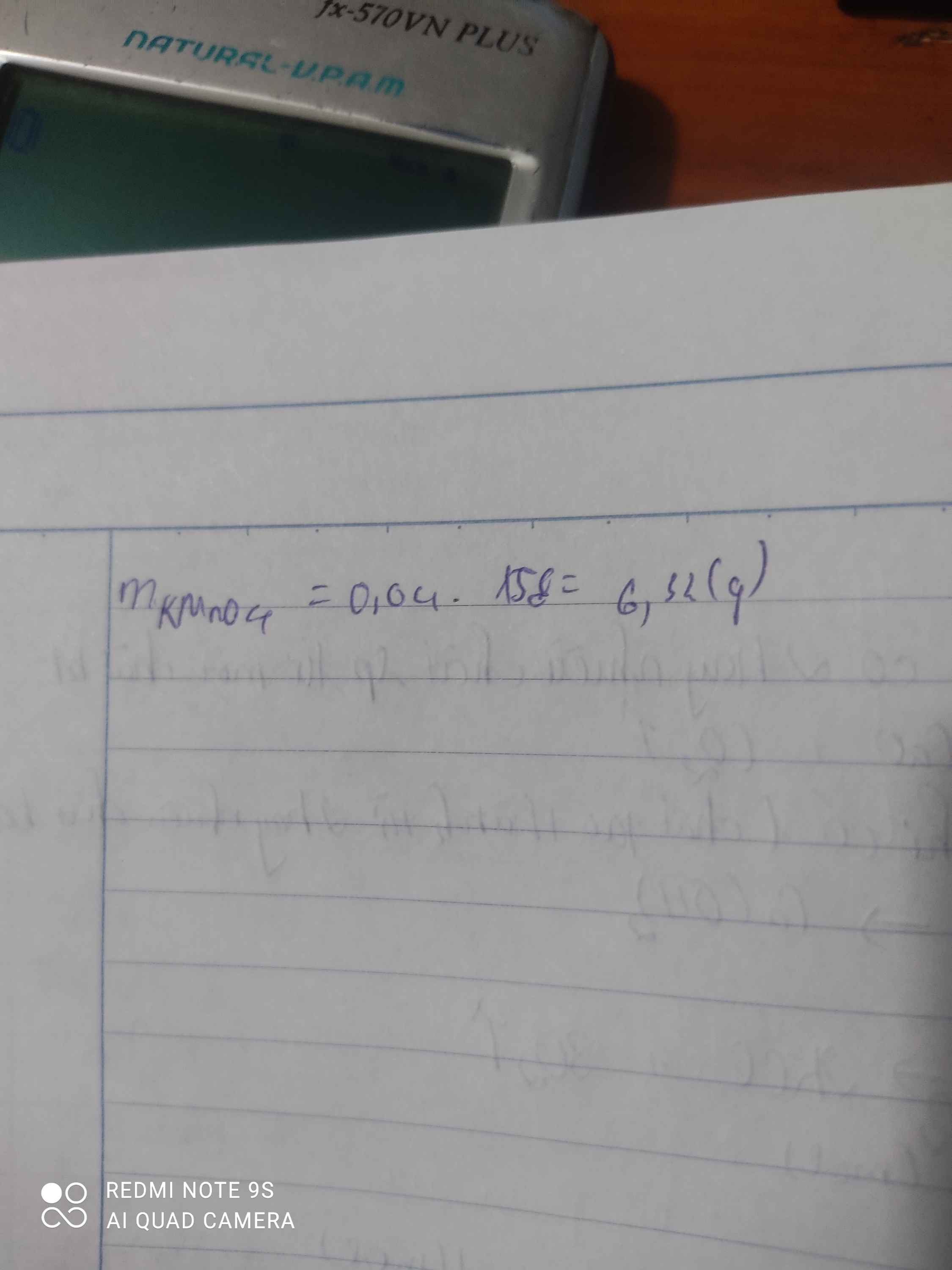

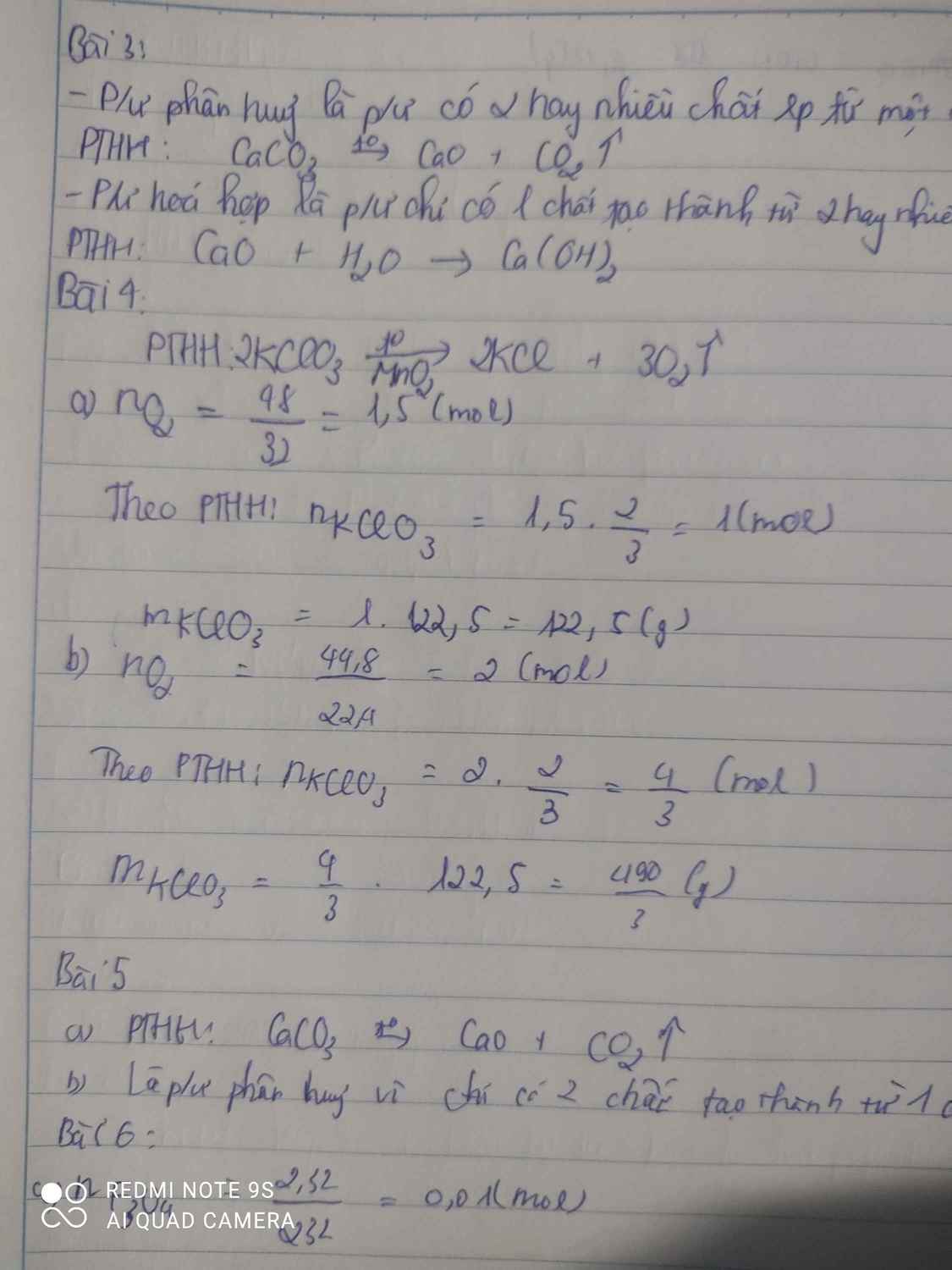
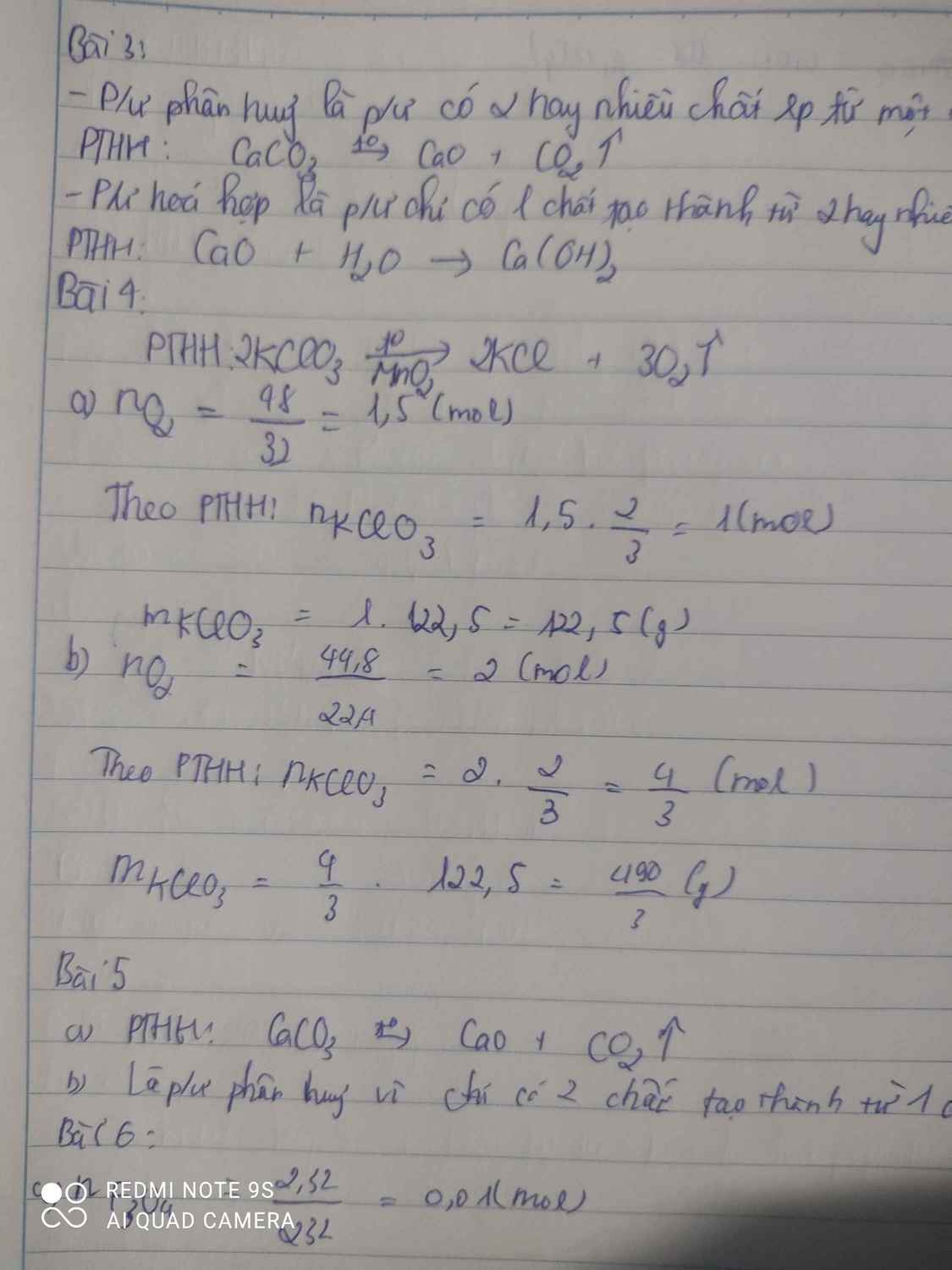

Không dùng đá vôi vì CaCO3 phân hủy tạo ra vôi tôi và CO2
Dùng Fe3O4 cần có nhiệt độ trên 1538 độ C
Dùng H2O cần điện phân ở nhiệt độ cao