Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Giả sử có 1 mol hỗn hợp đầu. Gọi x và y (mol) lần lượt là số mol của N₂ và H₂ trong 1 mol hỗn hợp đầu
Gọi n₁, P₁ và n₂, P₂ lần lượt là số mol hỗn hợp khí + áp suất trong bình ban đầu và lúc sau
⇒ n₁ = x + y = 1 (1)
Khi nhiệt độ không đổi
⇒ n₁ / n₂ = P₁ / P₂
Áp suất khí trong bình giảm 5% so với áp suất ban đầu ⇒ P₁ / P₂ = 20 / 19
⇒ n₁ / n₂ = 20 / 19 (2)
Số mol của nito đã phản ứng là 10% ⇒ N₂ pứ 0,1x mol
N₂ + 3H₂ → 2NH₃
Trước: x y 0
Pứ 0,1x 0,3x 0,2x
Sau: n N₂ = 0,9x ; n H₂ = y - 0,3x ; n NH₃ = 0,2x
⇒ n₂ = 0,9x + y - 0,3x + 0,2x
⇒ n₂ = 0,8x + y (3)
Từ (1) (2) & (3) ta có:
(x + y) / (0,8x + y) = 20 / 19
⇒ 3x - y = 0 (4)
Giải hệ (1) & (4) cho ta: x = 0,25 mol và y = 0,75 mol
Thành phần phần trăm về số mol của N₂ và H₂ trong hỗn hợp đầu là:
%N₂ = 25% và %H₂ = 75%

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 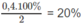
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).
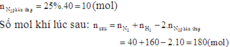
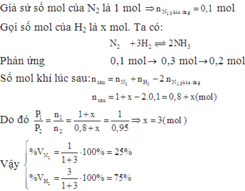
 A.
A.