Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

nNaHCO3= 0,2 mol⇒ nHCO3= 0,2 mol
nK2CO3= 0,2 mol⇒ nCO3= 0,2 mol
nH2SO4= 0,1 mol
nHCl= 0,1 mol
⇒∑nH+= 0,1.2+0,1=0,3 mol
PT:\(CO3^{2-}+H^+\rightarrow HCO3^-\)
____0,2____0,2______0,2
\(HCO3^-+H^+\rightarrow CO2+H2O\)
0,1______________0,1__0,1
⇒nHCO3= 0,2+0,2- 0,1= 0,3 mol
Cho Ba(OH)2 dư:
\(HCO3^-+OH^-\rightarrow CO3^{2-}+H2O\)
0,3____________________0,3
⇒m kết tuả= mBaCO3= 0, 3.197=59,1 g
VCO2 = 0,1.22,4= 2,24 l

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

Chọn C
Số mol Ba ( OH ) 2 = 0,2.0,01 = 0,002 mol; Số mol KOH = 0,2.0,03 = 0,006 mol
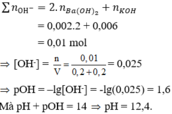

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C