Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Giả sử số proton, số nơtron, số electron của nguyên tố trên lần lượt là p; n và e.
Trong đó: p =e =z.
Ta có hpt:
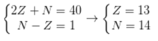
Cấu hình electron của nguyên tố là:
![]()
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p

Đáp án B
Giả sử số hiệu nguyên tử, số nơtron của nguyên tố trên lần lượt là Z, N
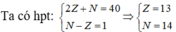
Cấu hình electron của nguyên tố là: 1s22s22p63s23p1
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p

Đáp án B
Giả sử số hiệu nguyên tử, số nơtron của nguyên tố trên lần lượt là Z, N
Ta có hpt:![]()
Cấu hình electron của nguyên tố là: 1s22s22p63s23p1
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p
→ Chọn B.

Z = số proton = số electron. N = số nơtron
Theo đề bài ta có : 2Z + N = 34
Ta biết rằng trong hạt nhân, số nơtron bao giờ cũng bằng hoặc lớn hơn số proton (trừ trường hợp duy nhất là hiđro có Z = 1).
N > Z. Vì vậy ta có : 3Z < 34, do đó Z < 34/3 = 11,3 (1)
Cũng vì N ≥ Z nên theo điều kiện của đề bài Z < 20, do đó :
N/Z ≤ 1,2 → N ≤ 1,2Z
Từ đó ta có : 2Z + N < 2Z + 1,2Z
34 < 3,2 => Z > 34/3,2 = 10,6 (2)
Tổ hợp (1) và (2) ta có : 10,6 < Z < 11,3 mà Z nguyên. Vậy Z = 11. Đó là nguyên tố natri có 11 proton, 11 electron, 12 nơtron.
Số khối của nguyên tử : A = Z + N = 23 => NTK là 23

a, Ta có: \(\left\{{}\begin{matrix}p+e+n=18\\p=e\\p=n\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=e=6\\n=6\end{matrix}\right.\)
b, \(NTK=p+n=6+6=12\left(đvC\right)\)

Chọn C
Với các nguyên tử bền, ta có
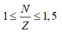
2p + n = 21 => n = 21 – 2p, thay vào (1) ta có
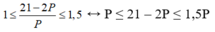
→ 6 ≤ P ≤ 7.
Với p = 6 → n = 9 → A = 15 (không có đáp án phù hợp).
Với p = 7 → n = 7 → A = 14 (đáp án C).

B
Giả sử số hiệu nguyên tử, số nơtron của nguyên tố trên lần lượt là Z, N
Ta có hpt:
Cấu hình electron của nguyên tố là: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
Theo trật tự phân mức năng lượng electron cuối cùng điền vào phân lớp p
→ nguyên tố trên thuộc loại nguyên tố p.