Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức electron và công thức cấu tạo của các phân tử sau :
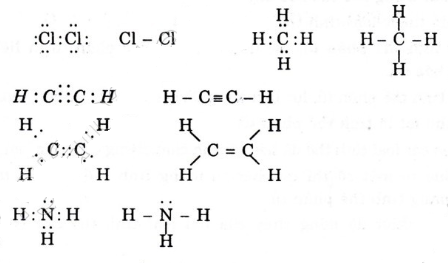

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
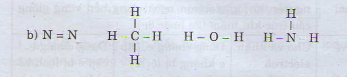
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

Công thức cấu tạo (trái) và công thức electron (phải) của :
\(BeCl_2\):
Cl → Be Cl ← :Cl::Be::Cl: .. ..
\(NH_3\):
H – N – H H H:N:H .. .. H
\(H_2O\):
H – O – H H:O:H .. ..
\(O_2\):
O = O :O::O: .. ..
\(SO_2\):
O = S → O :O::S:O: .. .. .. ..

Trả lời :
\(HNO\): \(H-N=O\)
\(C_2N_2\): \(N\equiv C-C\equiv N\)
\(HCN\): \(H-C\equiv N\)
\(C_3O_2\): \(O=C=C=C=O\)
\(N_2O\): \(N\equiv N\rightarrow O\)

1.\(Al:1s^22s^22p^63s^23p^1\)
Al có 13e → Số hiệu nguyên tử Z = Số e = 13 → Al nằm ở ô thứ 13
có 3 lớp e → ở chu kì 3
e cuối cùng điền vào phân lớp p → thuộc nhóm A
có 3e lớp ngoài cùng → thuộc nhóm IIIA
→ Al là kim loại, khi tham gia hình thành liên kết có xu hướng nhường 3e để đạt đến cấu hình bền của khí hiếm → thể hiện tính khử
\(S:1s^22s^22p^63s^23p^4\)
S có 16e → Số hiệu nguyên tử Z = Số e = 16 → S nằm ở ô thứ 16
có 3 lớp e → ở chu kì 3
e cuối cùng điền vào phân lớp p → thuộc nhóm A
có 6e lớp ngoài cùng → thuộc nhóm VIA
→ S là phi kim, khi tham gia hình thành liên kết có xu hướng nhận 2e để đạt đến cấu hình bền của khí hiếm → thể hiện tính oxi hóa
2.
a) Cl, Br, I thuộc cùng một nhóm, theo chiều tăng của điện tích hạt nhân tính phi kim giảm dần
→ Tính phi kim: Cl > Br > I
b) C, N thuộc cùng một chu kì, theo chiều tăng của điện tích hạt nhân tính axit của các axit tương ứng mạnh dần
→ Tính axit: H2CO3 < HNO3
c) Na, Mg thuộc cùng một chu kì, theo chiều tăng của điện tích hạt nhân, tính bazo của các hidroxit yếu dần
→ Tính bazo: NaOH > Mg(OH)2
Be, Mg thuộc cùng một nhóm, theo chiều tăng của điện tích hạt nhân, tính bazo của các hidroxit mạnh dần
→ Tính bazo: Be(OH)2 < Mg(OH)2
→Tính bazo: NaOH > Mg(OH)2>Be(OH)2

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
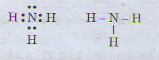

Công thức electron và công thức cấu tạo các phân tử sau: