Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 3:
Thí nghiệm 1 : Cho X tác dụng \(H_2SO_4\left(l\right)\)
\(n_{H_2}=1,15\left(mol\right)\\ BT\text{ }e\Rightarrow2n_{Mg}+3n_{Al}+2n_{Zn}+2n_{Fe}=2n_{H_2}=2,3\left(1\right)\)
Thí nghiệm 2 : Cho X tác dụng \(H_2SO_4\left(đ\right)\)
\(n_{SO_2}=1,225\left(mol\right)\\ BT\text{ }e\Rightarrow2n_{Mg}+3n_{Al}+2n_{Zn}+3n_{Fe}=2n_{SO_2}=2,45\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}2n_{Mg}+3n_{Al}+2n_{Zn}=2\\n_{Fe}=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=8,4\left(g\right)\Rightarrow\%Fe=23,14\%\)
Đặt \(n_{Mg}=a\left(mol\right);n_{Fe}=b\left(mol\right)\)
\(PTHH:Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
(mol)_____a_______a_________a______a
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
(mol)____b_______b________b_______b_
Theo đề ta có:
(*) 24a + 56b = 16
(**) \(16+\frac{98\left(a+b\right).100}{20}-2.\left(a+b\right)-\frac{98\left(a+b\right).100}{20}=15,2\)
\(\Rightarrow a=b=0,2\left(mol\right)\)
\(C\%_{MgSO_4}=\frac{0,2.120}{196}.100=12,24\left(\%\right)\)

\(Đặt:\)
\(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(m_{hh}=24x+56y=13.6\left(g\right)\\ n_{H_2}=x+y=0.3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0.1\\y=0.2\end{matrix}\right.\)
\(\%Mg=\dfrac{0.1\cdot24}{13.6}\cdot100\%=17.64\%\\ \%Fe=100-17.64=82.36\%\)
\(n_{HCl}=2n_{H_2}=2\cdot0.3=0.6\left(mol\right)\)
\(V_{HCl}=\dfrac{0.6}{2}=0.3\left(l\right)\)
\(m_Y=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.2\cdot127=34.9\left(g\right)\)

(Al, Fe, Zn, Mg) + HCl → Muối + H2 ↑↑
Khối lượng dung dịch sau phản ứng tăng: (m - 2) gam
⇒ (m - 2) = m - Khối lượng H2↑↑
⇒ Khối lượng H2↑↑ = m - m + 2 = 2 ⇒ nH2=22=1nH2=22=1 mol
Khối lượng muối = Khối lượng kim loại + Khối lượng gốc axit (Cl-)
Ta có: nCl−=2×nH2nCl−=2×nH2
⇒ Khối lượng muối = m + 2 × 35,5 = m + 71

Gọi số mol 2 kim loại Mg C a lần lượt là:x Y=>24X+40Y=10(1)
nHCl=0.7 mol=>X+Y=0,7.2=0.14(2)
từ 1 và 2=>X=gì đó(mk mất máy tính rùi)
=>SỐ MOL CỦA MGCL=X=.nồng độ phần trăm nhưng mà nhớ là cộng thêm khối lượng của 10g mg và ca nhé.p
![]()
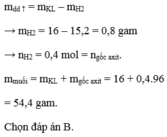
Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 24x + 56y = 16 (1)
Có: m dd tăng = mMg + mFe - mH2
⇒ mH2 = 16 - 15,2 = 0,8 (g) \(\Rightarrow n_{H_2}=\dfrac{0,8}{2}=0,4\left(mol\right)\)
BT e, có: 2nMg + 2nFe = 2nH2 ⇒ x + y = 0,4 (2)
Từ (1) và (2) ⇒ x = y = 0,2 (mol)
BTNT H, có: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{20\%}=146\left(g\right)\)
⇒ m dd sau pư = 146 + 15,2 = 161,2 (g)
BTNT Mg, có: nMgCl2 = nMg = 0,2 (mol)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{0,2.95}{161,2}.100\%\approx11,79\%\)